

CLÍNICA ESTOMATOLÓGICA DOCENTE
"DR. LUIS PÁEZ ALFONSO"
CIEGO DE ÁVILA
Procedimientos dentales, cardiopatía y endocarditis infecciosa
Dental procedures, heart disease and infectious endocarditis
Madelys Delgado ZamoraI, Yanet Elena González DocandoII, Lina Isabel Torres GarrizIII, María Ofelia Guerra PinaIV, Lázaro Jesús Hernández MayozV, Raquel María González DocandoVI.
RESUMEN
Introducción: la endocarditis infecciosa es una enfermedad potencialmente mortal; requiere tratamiento médico prolongado y, en algunos casos, quirúrgico; aunque su prevalencia es más baja en niños que en adultos, su incidencia en pacientes pediátricos podría aumentar por la mayor sobrevida de los infantes con malformaciones cardiovasculares. El manejo estomatológico de estos pacientes es complejo y presenta deficiencias producto del desconocimiento o desactualización acerca del tema entre el personal de Estomatología.
Objetivo: elaborar una reseña actualizada sobre el manejo de la profilaxis antibiótica de la endocarditis infecciosa en pacientes cardiópatas necesitados de tratamiento estomatológico.
Método: se revisó la literatura digital e impresa de los últimos cinco años sobre endocarditis infecciosa, procedimientos estomatológicos y profilaxis antibiótica en las bases de datos LILACS y Cochrane, en revistas nacionales y extranjeras, y en libros; con esta información se elaboró una reseña estructurada sobre el tema.
Conclusiones: la correcta higiene bucal y la adecuada atención estomatológica reducen la frecuencia de presentación de bacteriemias y, por tanto, son imprescindibles para prevenir el desarrollo de endocarditis infecciosa en pacientes con enfermedades cardiovasculares congénitas o adquiridas. En pacientes con cardiopatías o condiciones cardíacas asociadas a alto riesgo de desarrollar endocarditis infecciosa se recomienda la quimioprofilaxis específica para esta enfermedad previamente a cualquier intervención estomatológica que perfore la mucosa oral o que incluya manipulación del tejido gingival o de la región periapical del diente; los pacientes cardiópatas con riesgo moderado de desarrollar endocarditis infecciosa deben ser evaluados individualmente por el especialista para determinar la restricción de la profilaxis antibiótica.
Palabras clave: ATENCIÓN DENTAL PARA ENFERMOS CRÓNICOS, PROFILAXIS ANTIBIÓTICA, CARDIOPATÍAS/complicaciones, ENDOCARDITIS/prevención y control, LITERATURA DE REVISIÓN COMO ASUNTO.
ABSTRACT
Introduction: infectious endocarditis is a life-threatening disease; it requires prolonged medical treatment and, in some cases, surgical; although its prevalence is lower in children than in adults, its incidence in pediatric patients could increase by increased survival of infants with cardiovascular malformations. The dental management of these patients is complex and presents deficiencies product of ignorance or outdated on the subject among the staff of Stomatology.
Objective: to develop an update on the management of antibiotic prophylaxis of infectious endocarditis in cardiac patients in need of stomatological treatment.
Method: digital and printed literature of the past five years on infectious endocarditis, dental procedures and antibiotic prophylaxis in databases LILACS and Cochrane, in national and international magazines, and books were reviewed; with this information a structured review on the subject was prepared.
Conclusions: proper oral hygiene and proper dental care reduce the frequency of occurrence of bacteremia and, thus, both are essential to prevent the development of infectious endocarditis in patients with congenital or acquired heart disease. In patients with heart disease or cardiac conditions associated with high risk for infectious endocarditis is recommended specific chemoprophylaxis for this disease prior to any stomatological intervention which perforates the oral mucosa or that includes manipulation of the gingival tissue or the periapical region of the tooth; cardiac patients with moderate risk of developing infectious endocarditis should be individually assessed by a specialist to determine the restriction of antibiotic prophylaxis.
Keywords: DENTAL CARE FOR CHRONICALLY ILL, ANTIBIOTIC PROPHYLAXIS, HEART DISEASES/complications, ENDOCARDITIS/prevention and control, REVIEW LITERATURE AS TOPIC.
INTRODUCCIÓN
La endocarditis infecciosa (EI) es una enfermedad potencialmente mortal; requiere tratamiento médico prolongado y, en algunos casos, quirúrgico; aunque su prevalencia es más baja en niños que en adultos, su incidencia en pacientes pediátricos podría aumentar por la mayor sobrevida de los infantes con malformaciones cardiovasculares(1,2).
La EI es más frecuente en hombres que en mujeres (la relación es de 2:1), y afecta más a personas de la mediana edad (43,2 a 71,8 años). La incidencia anual de EI por edades aumenta desde cinco casos por 100 000 en menores de 50 años hasta entre 15 y 30 casos por 100 000 en la sexta y octava décadas de vida. Más de la mitad (50-75 %) de los pacientes con endocarditis de válvula nativa (EVN) padece enfermedades valvulares predisponentes(3).
A pesar de los avances en las terapias antimicrobianas, el diagnóstico temprano y las mejorías en las técnicas quirúrgicas, en los países desarrollados 10-25 % de los pacientes con EI fallecen(4). La incidencia y mortalidad de la EI aumentan con la edad; no obstante, las tasas de mortalidad difieren según el agente causal: en pacientes con EI producida por Streptococcus viridans, enterococos y Streptococcus gallolyticus varían entre 4-16 %, y son más altas en las EVN del hemicardio izquierdo causadas por Staphylococcus aureus (25-47 %), Streptococcus no viridans (13-50 %), Rickettsia y Coxiella burnetii (5-37 %), Pseudomonas aeruginosa, familia Enterobacteriaceae y hongos (más de 50 %)(3).
En Cuba no existen reportes de estudios completos para determinar la incidencia de EI en la población; una investigación retrospectiva realizada en Manzanillo (Granma) en una serie de necropsias de pacientes fallecidos por EI entre 1986 y 2008, reportó que la mayoría de los pacientes se ubican en las edades entre 44 y 70 años, la enfermedad afecta ambos sexos por igual y la mortalidad entre los pacientes es alta(5).
La aparición de endocarditis infecciosa requiere de la ocurrencia de dos sucesos fisiológicos: la presencia de una alteración del endocardio –generalmente provocada por una enfermedad previa o la presencia de un cuerpo extraño en el torrente circulatorio (casi siempre catéteres)– y la entrada de microorganismos al torrente circulatorio a través de alguna rotura de las barreras cutánea o mucosa. Entre las enfermedades o condiciones asociadas a daño endocárdico se encuentran las cardiopatías congénitas, la presencia de válvulas protésicas y las enfermedades de las válvulas cardíacas (valvulopatías); como causas de rotura de las barreras cutánea o mucosa se reconocen los procedimientos dentales (generalmente los más cruentos), las manipulaciones del aparato urinario (sobre todo en presencia de infección urinaria) o digestivo, y las infecciones de la piel, entre otras que provocan bacteriemias(3,4).
La bacteriemia después de procedimientos orodentales ocurre, en más de 20 % de los casos, tras el cepillado dental y, en casos de gingivectomías aparece en más de 90 % de los pacientes. Existen evidencias que respaldan el criterio de que las bacteriemias ocurren en 100 % de los pacientes sometidos a una extracción dental, en 70 % de los casos después de la tartrectomía dental, en 55 % luego de la extracción del tercer molar y en 20 % después del tratamiento pulpo radicular (TPR)(6). La mucosa oral y la bucofaringe son las puertas de entrada del Streptococcus viridans y éste, a su vez, del Staphylococus aureus; estos microorganismos se adhieren con mucha facilidad al trombo fibrinoplaquetario causante de la EI(3).
El sistema inmunológico normalmente elimina con rapidez las bacteriemias, por lo que éstas son transitorias; los pacientes con enfermedades crónicas (dolencias cardíacas, diabetes mellitus, trastornos renales y otras) son susceptibles a sufrir complicaciones después de la realización de procedimientos estomatológicos, por lo que es importante y necesario desarrollar estrategias para prevenir las bacteriemias mediante una adecuada profilaxis antibiótica y, con ello disminuir la incidencia de EI(6).
El manejo estomatológico de estos pacientes es complejo y presenta deficiencias producto del desconocimiento o desactualización acerca del tema entre el personal de Estomatología, particularmente en cuanto al uso de la profilaxis antibiótica previa al tratamiento estomatológico. Por esta razón el objetivo del presente trabajo es elaborar una reseña actualizada sobre el manejo de la profilaxis antibiótica de la endocarditis infecciosa en pacientes cardiópatas necesitados de tratamiento estomatológico.
MÉTODO
Se revisó la literatura digital e impresa de los últimos cinco años sobre endocarditis infecciosa, procedimientos estomatológicos y profilaxis antibiótica en las bases de datos LILACS y Cochrane, en revistas nacionales y extranjeras, y en libros; con esta información se elaboró una reseña estructurada sobre el tema.
DESARROLLO
Endocarditis infecciosa. Generalidades
La EI es una infección de la superficie endocárdica del corazón; se caracteriza por la presencia de vegetaciones compuestas de plaquetas, fibrina, microorganismos y células inflamatorias. Las válvulas nativas o protésicas son los sitios afectados con mayor frecuencia, pero la EI también puede afectar defectos septales, endocardio mural o cuerpos extraños como parches intracardíacos, anastomosis creadas por intervención quirúrgica y catéteres intravenosos. Los síntomas y signos de la endarteritis infecciosa son muy similares a la EI e incluyen infecciones del ductus arterioso, los grandes vasos, o de anastomosis arteriovenosas como la fístula de Blalock-Taussig(1-7).
Las cardiopatías congénitas son la principal condición predisponente para el desarrollo de la enfermedad durante la niñez. En recién nacidos con corazones estructuralmente normales la EI frecuentemente afecta la válvula tricúspide; la causa está en la infección de catéteres intravasculares. Más allá del período neonatal, en la mayoría de los niños con EI se identifican anomalías cardíacas estructurales preexistentes y, en 75-90 % de los casos se observan malformaciones cardíacas congénitas. En muchos casos la infección ocurre en el sitio de la reparación quirúrgica después de una intervención de cardiopatía compleja(3).
La EI es muy rara en pacientes con defectos interauriculares (reparados o no), en operados de defectos interventriculares, en casos con persistencia del conducto arterioso sin cortocircuito residual después de seis meses de la intervención quirúrgica, y en el prolapso de la válvula mitral (PVM) sin regurgitación; el PVM asociado a soplo de insuficiencia valvular es un factor predisponente a EI en niños(3).
El PVM con regurgitación es una anomalía estructural predisponente, frecuente en adultos con EI. El aumento del riesgo de padecer EI está limitado en gran parte a los pacientes que tienen prolapso, valvas engrosadas (>5 mm) y soplo de insuficiencia mitral, especialmente de sexo masculino y mayores de 45 años de edad. En los países en desarrollo las valvulopatías reumáticas aún son lesiones predisponentes para padecer EI, mientras que en las naciones desarrolladas 30 % de los casos que desarrollan EI se deben a las válvulas protésicas(3,4,8).
La cardiopatía congénita es el sustrato de la EI en 10-20 % de los adultos jóvenes y en 8 % de los adultos de más edad. En pacientes adultos las lesiones predisponentes más comunes son conducto arterioso permeable, comunicación interventricular y válvula aórtica bicúspide. El riesgo de EI en adictos a drogas endovenosas es varias veces mayor que en pacientes con cardiopatía reumática o con válvula protésica. De los pacientes que desarrollan EI 10 % no presentan cardiopatía estructural ni factores de riesgo identificables para el desarrollo de la enfermedad; en estos casos lo habitual es que una infección por Staphylococcus aureus afecte las válvulas aórtica o mitral(3,4,8).
Microbiología
Los agentes etiológicos de la EI por lo general son bacterias, y más raramente hongos (Rickettsia o Clamydia); las bacterias más frecuentemente aisladas son los cocos grampositivos, en especial Streptococcus viridans, Staphylococcus aureus y Enterococcus(3).
En países desarrollados el Streptococcus viridans es la causa de 18-30 % de los casos de endocarditis en válvula nativa (EVN) no relacionados con abuso de drogas y con la asistencia sanitaria; estas bacterias son parte de la flora normal de la orofaringe(3). Las variedades de Streptococcus no ß-hemolíticos causan EVN en diferentes proporciones (S. mitior 31 % de los casos, S. sanguis 24 %; S. bovis 27 %; S. mutans 7 %; S. milleri –ahora llamado grupo de S. anginosus y formado por S. intermedius, anginosus y constellatus– 4 %, S. faecalis (actualmente Enterococcus faecalis) 7 %, y S. salivarius y otros géneros 2 %. Las especies de Streptococcus adjacens y Streptococcus defectivus causan 5 % de los casos de EVN estreptocócica, mientras que S. gallolyticus (previamente S. bovis) aunque forma parte de la flora normal del tubo digestivo produce 20-40 % de los episodios de EVN estreptocócica(3).
Los estreptococos del grupo A no son causa frecuente de episodios de endocarditis; no obstante, en adictos a drogas endovenosas estas bacterias provocan EI de la válvula tricúspide similar a la causada por S. aureus. Los microorganismos del grupo B (entre ellos Streptococcus agalactiae, que es parte de la flora normal de la boca, el aparato genital y el tubo digestivo) infectan válvulas normales y anormales y producen un síndrome de EVN mórbida. El grupo de S. anginosus produce infecciones extracardíacas destructivas y EI con complicaciones intracardíacas. La EI por estreptococos i-hemolíticos (grupos A, B, C y G) se produce muchas veces sin valvulopatía previa y produce frecuentes complicaciones intracardíacas y extracardíacas(3).
Por su parte, S. pneumoniae produce sólo 1-3 % de los casos de EVN; la EI neumocócica afecta con frecuencia a una válvula aórtica normal y avanza rápidamente con destrucción valvular, formación de abscesos miocárdicos e insuficiencia cardíaca congestiva aguda(3).
E. faecalis y E. faecium causan 85 % y 10 % de los casos de EI enterocócica respectivamente. Los enterococos, que forman parte de la flora normal del tubo digestivo y producen infecciones urinarias, suponen 5-15 % de los casos de EVN y endocarditis de válvula protésica (EVP); la enfermedad habitualmente se produce con la misma frecuencia en hombres y mujeres ancianos (muchas veces desde una puerta de entrada urinaria), y 15-25 % de los casos son nosocomiales. Los enterococos infectan válvulas anormales y válvulas protésicas(3).
Los estafilococos positivos para coagulasa son una única especie denominada S. aureus. De las 13 especies de estafilococos negativos para coagulasa que colonizan a los seres humanos, S. epidermidis se ha convertido en un patógeno importante en los pacientes con dispositivos implantados y es causa frecuente de infecciones asociadas a la asistencia sanitaria(3).
El S. aureus es una causa importante de EI en todos los grupos de población; es la causa más frecuente de EI observada en series internacionales extensas de centros asistenciales terciarios(5). Los estafilococos negativos para coagulasa, particularmente S. epidermidis, son causas frecuentes de EVP, EI nosocomial y originan entre 8 % y 10 % de los casos de EVN, habitualmente cuando hay alteraciones valvulares previas. Las especies diferentes a S. epidermidis producen EVN no asociada a la asistencia sanitaria(3).
Las bacterias gramnegativas del grupo HACEK (Haemophilus parainfluenzae, Aggregatibacter aphrophilus, Aggregatibacter actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens y Kingella kingae) que forman parte de la flora del aparato respiratorio superior y de la orofaringe, infectan válvulas cardíacas anormales y producen EVN y EVP subagudas que se manifiestan un año o más después de la intervención quirúrgica valvular(3).
Los bacilos gramnegativos, a pesar de producir episodios frecuentes de bacteriemia, están implicados tan sólo en casos esporádicos de EI (Escherichia coli y Pseudomonas aeruginosa son las especies implicadas con más frecuencia); la tasa de mortalidad en estos casos es elevada (25-50 %)(3).
Neisseria gonorrhoeae es una causa poco frecuente de endocarditis en la actualidad; produce EI aguda con destrucción valvular y abscesos intracardíacos. Otras especies de Neisseria (no gonocócicas y no meningocócicas) producen episodios de EI subaguda, habitualmente cuando existe valvulopatia previa(3).
El género Corynebacterium (denominado diphtheriae) con frecuencia aparece como contaminante en hemocultivos, aunque no se puede ignorar cuando se aísla en múltiples hemocultivos; estos gérmenes son causa importante de EVP y producen endocarditis en válvulas anormales. Listeria monocytogenes infecta algunas veces válvulas cardíacas izquierdas anormales y dispositivos protésicos; Tropheryma whipplei (causa de la enfermedad de Whipple) produce una forma afebril y críptica de EI con artralgias asociadas, pero sin diarrea, así como valvulopatía, como parte de la enfermedad de Whipple clásica. La rickettsia Coxiella burnetii es una causa infrecuente de EI en EE.UU., pero en otros países lo es frecuentemente; en estos casos la EI se produce después de la infección aguda por C. burnetii (fiebre Q) en personas con válvulas mitrales o aórticas anormales(3).
Bartonella quintana y Bartonella henselae, en conjunto, causan 3 % de los casos de EVN; B. henselae (que es conocido por ser el agente causal de la enfermedad por arañazo de gato) produce EI en pacientes con lesión valvular previa y contacto con gatos, mientras que B. quintana (microorganismo causante de la fiebre de las trincheras) produce EI en válvulas normales, principalmente en pacientes que viven en condiciones de indigencia y, por tanto, están expuestos a padecer pediculosis corporal. La EI por Bartonella se manifiesta de forma insidiosa, el diagnóstico muchas veces es tardío, y la infección con frecuencia se complica por insuficiencia cardíaca congestiva y embolia sistémica(3).
Entre los hongos, los géneros Candida, Histoplasma y Aspergillus son los agentes causales más frecuentes de EI, y los hongos y mohos denominados emergentes son causa infrecuente de la enfermedad (25 % de los casos). Entre los factores de riesgo para estos gérmenes se encuentran intervención quirúrgica valvular previa, uso de antibióticos, abuso de drogas inyectadas, catéteres endovenosos, intervenciones quirúrgicas (no cardíacas) e inmunodepresión(3).
Patogénesis
Las interacciones entre el anfitrión humano y algunos microorganismos que culminan en EI suponen la participación del endotelio vascular, mecanismos hemostáticos, el sistema inmunitario del anfitrión, alteraciones anatómicas macroscópicas del corazón, propiedades de la superficie de los microorganismos, así como producción de enzimas y toxinas por ellos, y fenómenos periféricos que inician la bacteriemia. El endotelio intacto es relativamente resistente a la colonización por microorganismos; sin embargo, la erosión o daño del endocardio es un potente inductor de trombogénesis. La deposición inicial de plaquetas y fibrina sobre el endotelio dañado se conoce como endocarditis trombótica no bacteriana (ETNB). Cuando se produce una bacteriemia los microorganismos que entran al torrente sanguíneo colonizan la superficie endocárdica alterada y convierten la ETNB en EI(4).
Los dos mecanismos fundamentales en la formación de la ETNB son la lesión endotelial y el estado de hipercoagulabilidad. La ETNB se produce en la línea de contacto de cierre de la válvula en las superficies auriculares de las válvulas mitral y tricúspide, y en las superficies ventriculares de las válvulas aórtica y pulmonar; el endotelio se puede lesionar –y con ello iniciar la ETNB– por circunstancias hemodinámicas tales como un chorro de alta velocidad que golpee el endotelio, el flujo procedente de una cavidad de presión elevada a una cavidad de presión baja, y el flujo a través de un orificio estrecho a una velocidad elevada. Durante la bacteriemia, el flujo sanguíneo a través de un orificio estenótico deposita bacterias inmediatamente detrás de un orificio (sobre todo en la cavidad de baja presión) como consecuencia del efecto Venturi, o en el punto en el que la corriente de un chorro golpea una superficie(3).
La bacteriemia es el fenómeno que convierte la ETNB en EI. La frecuencia y la magnitud de la bacteriemia asociada a las actividades diarias y a distintas técnicas de asistencia sanitaria aparentemente están en dependencia de las superficies mucosas específicas y la piel afectadas, la densidad de las bacterias colonizadoras, el estado de la superficie y la magnitud del traumatismo local. La incidencia de bacteriemia se eleva al máximo durante la realización de técnicas que producen traumatismos de la mucosa oral, particularmente las encías, y disminuye progresivamente con las intervenciones que afectan al aparato genitourinario y el tubo digestivo(3).
Cuadro clínico
Según los síntomas y signos, la EI puede ser aguda y subaguda. La causa de EI aguda habitualmente es el Staphylococus aureus; en un período que oscila entre unos días y varias semanas la infección progresa hasta la destrucción valvular e infección metastásica. Las causas de EI subaguda suelen ser varios gérmenes (Streptococcus viridans, Enterococcus, estafilococos negativos para coagulasa o cocobacilos gramnegativos); en estos casos la infección evoluciona durante semanas o meses con una toxicidad moderada y raras veces produce infección metastásica(3,9-11).
Las manifestaciones de la EI son muy variables; el síntoma más común es la fiebre prolongada durante semanas o meses (excepcionalmente ausente) y sin un patrón específico; pueden aparecer malestar general, anorexia, pérdida de peso, cansancio, mialgias, cefaleas y trastornos del sueño; los síntomas digestivos son menos frecuentes. Las complicaciones embólicas aparecen en 50 % de los casos. Los pacientes pueden llegar a padecer insuficiencia cardíaca congestiva y, los casos que presentan lesiones preexistentes pueden sufrir una exacerbación de éstas. Es posible detectar soplo por auscultación en 90 % de los pacientes, y la esplenomegalia es usual en la forma subaguda de la enfermedad. Las lesiones cutáneas son más comunes en los adultos, mientras que en niños la aparición de petequias es más frecuente(3).
Cavidad bucal y EI
Hasta el momento del nacimiento el niño se encuentra en un ambiente estéril pero inmediatamente después de nacido los microrganismos colonizan la piel, nariz, cavidad oral y otras partes de su cuerpo; esta colonización ocurre al ponerse el niño en contacto con el canal del parto y, posteriormente, con el ambiente que lo rodea. Estos microorganismos, capaces de adherirse a los epitelios, colonizarlos y posteriormente multiplicarse en ellos, forman parte de la microbiota humana y proceden de las personas que se relacionan con el niño(12).
Aunque los microorganismos que forman parte de la microbiota humana se adquieren en la infancia, varios factores (edad, sexo, tipo de alimentación, ambiente y sistema inmunológico del individuo) los modifican con el paso de los años. La microbiota de la cavidad bucal posee características particulares debido a las condiciones de humedad, acidez (pH), presencia de dientes y consiguiente formación de placa dentobacteriana; la formación de la variada flora bucal se asocia a la aparición de variadas dolencias (caries, abscesos, enfermedad periodontal) y a factores tales como el desdentamiento o el uso de aparatos artificiales, entre otros. La erupción de los dientes en la boca genera colonizaciones de la superficie dental por Streptococcus sanguis y Streptococcus mutans (estas especies sólo colonizan superficies duras como la hidroxiapatita)(12).
La microbiota oral es variada y está compuesta sobre todo por cocos grampositivos (S. viridans, S. mutans, S. sanguis, S. salivarius, S. oralis y S. mitis); otras especies existentes en menor cantidad son cocos gramnegativos, bacilos (gramnegativos y grampositivos), espiroquetas y hongos. No obstante, esta flora es muy cambiante en dependencia de los factores antes mencionados(12).
La flora normal de una boca sana y dentada está compuesta por varios microorganismos cuyas proporciones varían desde aproximadamente 85 % de Streptococcus, Veillonella, Corynebacterium diphtheriae grampositivo y bacilos anaerobios gramnegativos, a 5-7 % del género Neisseria, 2 % de Lactobacillus, 1 % de Staphylococcus, 2 % de Mycobacterium, bacterias filamentosas y un remanente de otras bacterias, hongos, protozoos y virus(13).
Algunos estudios sugieren que más que 700 especies de bacterias (incluyendo microorganismos aerobios y anaerobios, grampositivos y gramnegativos) se encuentran en la boca humana, en particular en los dientes y las encías (región cervical); aproximadamente 30 % de la flora de los espacios subgingivales se compone de S. viridans (este grupo tiene tasas de prevalencia elevadas entre las más de 100 especies bacterianas de la flora oral identificadas en hemocultivos posteriores a procedimientos dentales, y es la causa microbiológica más común de endocarditis infecciosa de válvula nativa)(14).
En la cavidad bucal sana una delgada y potente mucosa epitelial impide a las bacterias patógenas entrar en el torrente circulatorio y el sistema linfático; por lo general, la enfermedad periodontal se debe a la presencia de microorganismos anaerobios que, frecuentemente, entran en la corriente sanguínea por la ruptura de esta membrana, aunque raras veces causan EI (se reportan pocos casos). El S. viridans predomina en la flora de la cavidad bucal sana y limpia; este microorganismo es antagónico para patógenos periodontales(14).
El origen de las infecciones orales generalmente es polimicrobiano; éstas pueden causar bacteriemias de origen dental. Las infecciones bucales que se producen en los dientes o los tejidos que los rodean se extienden al periodonto, al ápice del diente y de ahí al hueso de sostén, por donde se diseminan tanto a los tejidos cercanos como a los más distantes; la diseminación a distancia es lo más significativo en estos casos, por las manifestaciones sistémicas que pueden poner en peligro la vida de los pacientes(15).
La bacteriemia de origen dental consiste, esencialmente, en el paso de bacterias de la cavidad oral al torrente circulatorio; ocurre después de un procedimiento invasivo y las infecciones dentarias pueden potenciarla (estas infecciones se pueden deber a la existencia de caries dental, pulpitis, enfermedades periodontales periimplantarias, infecciones del tejido celular subcutáneo, infecciones de los maxilares, sinusitis maxilar de origen odontógeno y alveolitis seca). La facilidad con que se disemina la infección en la cavidad oral se debe a la permeabilidad de los tejidos epiteliales que rodean a los dientes, los niveles de prostaglandinas en la circulación local (si están aumentados, favorecen el aumento de leucocitos y fibrinógeno en los vasos, desaceleran la circulación sanguínea y favorecen el paso de microorganismos a la sangre)(15).
Los traumas de la mucosa oral, en particular de las encías, se asocian con aumento del riesgo de bacteriemias debido a la flora normal presente en la boca (sin importar si se trata de una cavidad bucal sana o enferma). La bacteriemia puede aparecer después de una extracción dental, sobre todo en pacientes con enfermedad periodontal o con extracciones múltiples. Las bacteriemias transitorias por S. viridans pueden ser el resultado de cualquier procedimiento dental que incluya manipulación de la región gingival o periapical del diente o perforación de la mucosa oral; no obstante, también se pueden originar a partir de manipulaciones comunes en la cavidad oral (cepillado dental, uso de seda dental y de dispositivos de irrigación con agua o durante la masticación)(3,4,15).
Se estima que del cepillado dental dos veces al día durante un año resulta una exposición a la bacteriemia 154 000 veces mayor que de la extracción de un diente, aún cuando esta última es una de las intervenciones asociadas a mayores riesgos de exposición de las estructuras cardíacas a bacteriemia(3,14).
Aunque en la literatura tradicionalmente se ha recogido la importancia de los procedimientos dentales en el desarrollo de EI, consta también que la mayoría de los pacientes que han padecido la enfermedad no tienen historia de intervenciones dentales dos semanas antes del inicio de los síntomas; por ello, actualmente muchos autores ponen el énfasis en la exposición acumulativa a inoculaciones mínimas de microorganismos (ocurridas durante las manipulaciones cotidianas) y no en los procedimientos dentales profesionales como causas de EI(3,4,14,16,17).
La higiene dental deficiente y la presencia de infecciones periodontales o periapicales son causas de bacteriemia, aún cuando no se hayan realizado procedimientos dentales profesionales. Mantener los cuidados dentales, la higiene y salud orales óptimas son medidas imprescindibles para la prevención de EI en pacientes con enfermedad cardíaca; para prevenir la aparición de EI en pacientes candidatos a intervenciones quirúrgicas cardíacas o cateterismo, los procedimientos dentales que requieran se deben realizar antes de las intervenciones quirúrgicas(7,15).
Según Bascones Martínez la incidencia de casos de bacteriemias originadas en actividades diarias y maniobras de higiene oral oscila desde 0-26 % por cepillado dental, 20-58 % por uso de seda dental, 20-40 % por empleo de palillos de dientes, 7-50 % por irrigación hasta 17-51 % por masticación. La elevada tasa de bacteriemias originadas en actividades de la vida diaria hace que se desestime la posibilidad de control de la EI provocada por bacterias de la cavidad bucal mediante profilaxis antibiótica y se haga énfasis en la higiene y salud bucales como medidas preventivas(16). A este respecto, la Asociación Americana del Corazón (AAC) recomienda a los pacientes cardiópatas mantener la higiene y salud orales adecuadas con vistas a reducir la incidencia de bacteriemias de la cavidad oral asociadas a la realización de actividades diarias(7,15).
Las evidencias científicas actuales sugieren que la asociación entre procedimientos odontológicos y EI es tenue; las potencialidades de los antibióticos y antisépticos tópicos recomendados para prevenir o reducir las bacteriemias ocasionadas por intervenciones dentales se reducen por el aumento gradual de la frecuencia de resistencia del Streptococcus viridans. Los estudios poblacionales realizados en los Países Bajos permitieron concluir que las intervenciones dentales producen una proporción muy baja de casos de EI y que la profilaxis con antibióticos, aunque sea eficaz permite prevenir su aparición en sólo un pequeño número de casos(3,4).
Profilaxis de la EI
Como la patogenia de la EI se asocia a bacteriemia transitoria, la profilaxis antibiótica se asumió durante años como una práctica de elección en pacientes de riesgo sometidos a procedimientos potencialmente causantes de bacteriemias; organizaciones de diferentes países emitieron guías y documentos de consenso con estas recomendaciones, que se siguieron hasta hace unos años aún cuando no se publicaran ensayos clínicos prospectivos aleatorizados que demostraran la eficacia de la profilaxis antibiótica en enfermedades cardíacas. En la actualidad las nuevas propuestas restringen la lista de enfermedades que requieren profilaxis antibiótica debido a que el número de casos que se podrían prevenir con esta práctica es mínimo (aún cuando fuese 100 % efectiva)(3,15).
Estas últimas directrices aclaran que las recomendaciones previas se basaban en investigaciones que demostraban que la profilaxis antimicrobiana es eficaz para la prevención de la EI experimental en modelos animales, y reconocen que no existen datos palpables de su eficacia en seres humanos(3). Por otra parte la etiología de la EI ha sufrido cambios en las últimas décadas al punto que el Streptococcus viridans ya no es su principal agente etiológico; actualmente ocupan un lugar preeminente los microorganismos no orales como Staphylococcus aureus, lo que le quita importancia a la profilaxis antibiótica tal como se realizaba con anterioridad(3,16).
Para estos cambios se tuvo en cuenta la relación costo-beneficio del uso de antibióticos de manera preventiva, por el incremento en los últimos años de la resistencia de los microorganismos de la cavidad bucal a los antibióticos y el riesgo de presentación de efectos adversos que implica su uso (anafilaxia, reacciones en la piel, alteraciones gastrointestinales, problemas hepáticos y complicaciones hematológicas)(16,18). Las guías más recientes del National Institute for Health and Care Excellence (NICE) en Inglaterra y Gales indican que no es necesario administrar antibióticos en los procedimientos dentales o quirúrgicos (16,19).
Por su parte, las guías más recientes sobre la prevención de la endocarditis infecciosa, publicadas por la AAC y aprobadas por la Asociación Dental Americana en 2007, limitan las recomendaciones para el uso de la profilaxis antibiótica de la EI(3,19) (Tabla No.1).
Tabla No.1. Razones para limitar la profilaxis antibiótica de la endocarditis infecciosa a pacientes cardiópatas según el Comité de Revisión de las Guías de la AAC y la Sociedad Europea de Cardiología.

En el año 2009 la Sociedad Europea de Cardiología estableció guías similares para la quimioprofilaxis de la enfermedad(4). En el Reino Unido ha disminuido considerablemente el uso de la profilaxis antibiótica –y ello no ha redundado en incremento significativo de reportes de EI– tras su drástica restricción y la ejecución de un trabajo preventivo basado en la educación de los pacientes en cuanto a la correcta higiene bucal, el conocimiento de los riesgos que conllevan los procedimientos invasivos así como la importancia del diagnóstico y atención precoces ante la aparición de síntomas sospechosos de EI(16).
La AAC y la Sociedad Europea de Cardiología establecieron una lista de las condiciones cardíacas asociadas con alto riesgo de aparición de endocarditis, entre ellas la existencia de válvulas cardíacas protésicas, antecedentes de episodios previos de EI, valvulopatías posteriores a trasplante cardíaco, cardiopatía congénita (sólo si existe una cardiopatía cianótica no reparada), existencia de derivaciones paliativas y conductos anastomosados, defectos cardíacos reparados completamente con material protésico, dispositivos colocados mediante cirugía o cateterismo intervencionista durante los primeros seis meses del procedimiento, cardiopatías congénitas reparadas pero con defectos residuales en el sitio, o adyacentes al sitio del parche o del dispositivo, que impiden su endotelización(4,7,14,20,21) (Tabla No.2).
Tabla No.2. Condiciones cardíacas asociadas a riesgo elevado de EI con evolución desfavorable en la cuales se recomienda quimioprofilaxis.

En Cuba la atención a los pacientes especiales es prioridad del Sistema Nacional de Salud (SNS); entre estos pacientes se incluyen los enfermos cardiópatas. Según Valdés Herrera, la profilaxis antibiótica se recomienda en los casos de cardiopatías congénitas (acianóticas y ciánóticas)(22).
Dentro de las cardiopatías acianóticas, las más frecuentes son la comunicación interventricular y la persistencia del conducto arterioso con aumento del flujo pulmonar. Ante flujo pulmonar aumentado hay que pensar en la existencia de comunicación interventricular, persistencia del conducto arterioso, comunicación interauricular o defectos septales auriculoventriculares (son frecuentes en pacientes con síndrome de Down). Un flujo pulmonar normal indica la presencia de estenosis aórtica o pulmonar y coartación aórtica; mientras que el flujo pulmonar disminuido puede deberse a estenosis pulmonar(22).
Las cardiopatías ciánóticas se clasifican de acuerdo al estado del flujo pulmonar (normal, aumentado o disminuido). Con flujo pulmonar normal es una cardiopatía de Ebstein; el flujo pulmonar disminuido puede indicar la existencia de una tetralogía de Fallot (es la más frecuente), atresia pulmonar o atresia tricuspídea; el flujo aumentado puede significar existencia de transposición de los grandes vasos, tronco común o ventrículo común(22).
Igualmente se recomienda la profilaxis antibiótica en los pacientes operados de cardiopatías congénitas que tengan prótesis intracardíacas, puesto que éstas suelen ser fácilmente asiento de microrganismos, y en pacientes con antecedentes de fiebre reumática que presenten secuelas (soplos)(22).
En cuanto al régimen de profilaxis, la escuela cubana propone dos variantes: el uso de antibióticos antes, durante y dos o tres días después del procedimiento, preferiblemente con penicilina y sus derivados (un millón diario de unidades, desde un día antes del procedimiento estomatológico hasta completar cinco días de tratamiento); o administrar estos mismos antibióticos por vía parenteral una hora antes, y seis horas después (preferiblemente por vía endovenosa). En pacientes alérgicos a la penicilina se recomienda utilizar eritromicina (25-50 mg/Kg de peso, 24 horas antes, y cada seis u ocho horas posteriormente, hasta completar cinco días de tratamiento), o azitromicina(22).
En comparación con las recomendaciones internacionales, la escuela cubana de Estomatología es conservadora respecto al uso de profilaxis antibiótica en pacientes cardiópatas; en general recomienda períodos prolongados de terapia antibiótica ante cualquier procedimiento estomatológico y en enfermedades cardíacas que no tienen un alto riesgo de inducir EI, al tiempo que no hace énfasis en la verdadera prevención (orientar a los pacientes hacia el mantenimiento de una higiene y salud orales adecuadas), lo que reduciría la frecuencia de aparición de bacteriemias asociadas a las actividades diarias. A este respecto, la AAC recomienda el uso de derivados sintéticos de la penicilina (amoxicilina) como profilaxis antibiótica para la EI en intervenciones dentales, orales y del tracto respiratorio superior; el antibiótico se debe administrar dentro de la hora previa al procedimiento para garantizar altas concentraciones en sangre durante el momento de mayor bacteriemia; no se debe administrar cefalosporinas a los pacientes con antecedentes de reacción anafiláctica severa, angioedema o urticaria tras la administración de penicilina(3,7) (Tabla No.3).
Tabla No.3. Regímenes para la profilaxis de la endocarditis infecciosa en intervenciones dentales, orales y del aparato respiratorio superior.
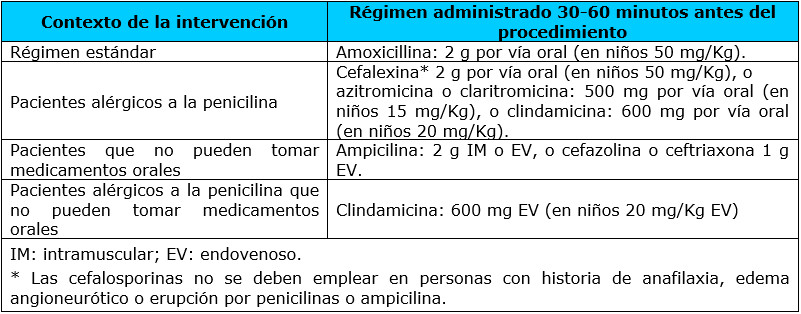
Tabla No.4. Procedimientos estomatológicos para los que se recomienda profilaxis antibiótica.

No se justifica el uso de profilaxis antibiótica en procedimientos tales como la inyección de un anestésico intraoral a través de tejido no infectado, realización de radiografías dentales, colocación o ajuste de abrazaderas u otros dispositivos prostodóncicos u ortodóncicos extraíbles, caída de los dientes primarios y sangrado por traumatismos de la mucosa labial u oral(3,4) (Tabla No.5).
Tabla No.5. Procedimientos estomatológicos que no requieren profilaxis antibiótica.

CONCLUSIONES
La correcta higiene bucal y la adecuada atención estomatológica reducen la frecuencia de presentación de bacteriemias y, por tanto, son imprescindibles para prevenir el desarrollo de endocarditis infecciosa en pacientes con enfermedades cardiovasculares congénitas o adquiridas. En pacientes con cardiopatías o condiciones cardíacas asociadas a alto riesgo de desarrollar endocarditis infecciosa se recomienda la quimioprofilaxis específica para esta enfermedad previamente a cualquier intervención estomatológica que perfore la mucosa oral o que incluya manipulación del tejido gingival o de la región periapical del diente; los pacientes cardiópatas con riesgo moderado de desarrollar endocarditis infecciosa deben ser evaluados individualmente por el especialista para determinar la restricción de la profilaxis antibiótica.
REFERENCIAS BIBLIOGRÁFICAS
Recibido: 22 de junio de 2016
Aprobado: 13 de julio de 2016
MSc. Yanet Elena González Docando
Clínica Estomatológica Docente "Dr. Luis Páez Alfonso"
Calle Independencia No.305, e/4ta. y Carretera Central. Ciego de Ávila, Cuba. CP.65100
Correo electrónico: yanetegd@ced.cav.sld.cu