

Informe de caso
Disección aórtica tipo A de Stanford, y muerte súbita por fibrilación ventricular. Informe de caso
Stanford type A aortic dissection and sudden death due to ventricular fibrillation. Case report
Yander Luis Izaguirre-Campillo1* https://orcid.org/0000-0001-7669-5951
https://orcid.org/0000-0001-7669-5951
Melissa Hernández-Cardoso2 https://orcid.org/0009-0000-5433-9016
https://orcid.org/0009-0000-5433-9016
Luis Alejandro Wong-Pitty3 https://orcid.org/0009-0003-5856-7907
https://orcid.org/0009-0003-5856-7907
1Doctor en Medicina. Residente en Cardiología. Aspirante a Investigador. Hospital Clínico Quirúrgico “Hermanos Ameijeiras”. La Habana, Cuba.
2Doctor en Medicina. Residente en Cardiología. Hospital Clínico Quirúrgico “Hermanos Ameijeiras”. La Habana, Cuba.
3Especialista de Primer Grado en Medicina Interna. Residente en Cardiología. Hospital Clínico Quirúrgico “Hermanos Ameijeiras”. La Habana, Cuba.
*Autor para la correspondencia. Correo electrónico:  yanderizaguirrecampillo@gmail.com
yanderizaguirrecampillo@gmail.com
RESUMEN
Introducción: la disección aórtica es una afección grave; se caracteriza por la formación de una luz falsa debido a la rotura de la capa íntima de la aorta. Su incidencia anual oscila entre 2,7 y 7,2 x 100 000 habitantes; su mortalidad es de 0,7 a 3,2. La muerte súbita asociada a fibrilación ventricular sucede en 22 % de los pacientes; generalmente, por compromiso coronario, renal, o hidroelectrolítico.
Objetivo: describir un caso inusual de disección aórtica, y muerte súbita por fibrilación ventricular.
Presentación del caso: paciente masculino, caucásico, de 55 años de edad e hipertenso. Ingresó en emergencia hipertensiva, con dolor retroesternal súbito e intenso, síncope, y disnea de esfuerzo. Mediante angiotomografía se le diagnosticó disección aórtica tipo A de Stanford, extendida a la arteria ilíaca común derecha. Durante la operación sufrió fibrilación ventricular, revertida con la primera descarga. En cuidados intensivos posquirúrgicos se le repitió la fibrilación ventricular, y al segundo choque presentó asistolia. Tras 30 minutos de maniobras de reanimación y administración de epinefrina endovenosa, el paciente no se recuperó y falleció.
Conclusiones: la evolución de la disección aórtica es rápida y tórpida; por tanto, es una emergencia. De las técnicas de imagen imprescindibles en su diagnóstico, la tomografía angiográfica es el estándar de oro. El tratamiento suele ser quirúrgico abierto, con o sin reemplazo valvular aórtico. Este caso aportó evidencias diagnósticas e imagenológicas singulares sobre la disección aórtica, y los compromisos renal o electrolítico como causas de fibrilación ventricular. Esta última es una complicación infrecuente pero letal.
Palabras clave: disección aórtica; fibrilación ventricular; informes de casos; muerte súbita cardíaca; síndrome aórtico agudo.
ABSTRACT
Introduction: aortic dissection is a serious condition characterized by the formation of a false lumen due to the rupture of the aortic intima. Its annual incidence ranges between 2.7 and 7.2x 100,000 inhabitats; its mortality rate is 0.7 to 3.2. Sudden death associated with ventricular fibrillation occurs in 22 % of patients, usually due to coronary, renal, or electrolyte compromise.
Objective: to describe an unusual case of aortic dissection and sudden death due to ventricular fibrillation.
Case presentation: a 55-year-old caucasian male patient with hypertension was admitted to the hypertensive emergency department with sudden, severe retrosternal pain, syncope, and exertional dyspnea. Angiotomography diagnosed Stanford type A aortic dissection extending to the right common iliac artery. During surgery, he suffered ventricular fibrillation, which was reversed with the first shock. In postoperative intensive care, ventricular fibrillation recurred, and after the second shock, he presented asystole. After 30 minutes of resuscitation maneuvers and administration of intravenous epinephrine, the patient did not recover and died.
Conclusions: the progression of aortic dissection is rapid and torpid; therefore, it is an emergency. Of the essential imaging techniques for diagnosis, angiographic computed tomography is the gold standard. Treatment is usually open surgery, with or without aortic valve replacement. This case provided unique diagnostic and imaging evidence regarding aortic dissection and renal or electrolyte compromise as causes of ventricular fibrillation. The latter is a rare but fatal complication.
Keywords: acute aortic syndrome; aortic dissection; case reports; sudden cardiac death; ventricular fibrillation.
Recibido: 21/06/2025
Aprobado: 02/07/2025
Publicado: 20/08/2025
La disección aórtica es una emergencia cardiovascular infrecuente, pero de letalidad alta. Consiste en la separación de las capas de la pared arterial, tras una rotura de la íntima; por la cual penetra sangre en la capa media y se forma una luz (lumen) falsa. Esta afección tiene una incidencia anual oscilante entre 2,7 y 7,2 x 100 000 habitantes. Es más frecuente en pacientes de sexo masculino (2:1), y edades entre 50 y 70 años; no obstante, se diagnostica en personas por debajo de esas edades, con diagnósticos de síndromes genéticos (Marfán, aorta bicúspide, Loeys-Dietz o Ehlers-Danlos vascular).(1,2)
La distribución geográfica de esta afección presenta diferencias notables. En Japón se reportan tasas anuales de incidencia significativamente altas (hasta 15,8 x 100 000 habitantes) a partir de estudios poblacionales exhaustivos (revisiones de registros de autopsias y certificados de defunción).(2,3) En Estados Unidos y algunos países europeos, oscilan entre tres y siete casos; no obstante en Suecia se han reportado hasta 16.(4,5)
Las tasas de mortalidad anuales, ajustadas por edades, varían entre 0,7 y 3,2 x 100 000 habitantes. Las más altas se registran en países asiáticos como Japón, y las más bajas en occidentales como Estados Unidos y Canadá. Entre los años 1999 y 2019, hubo 86 855 muertes por disección aórtica en Estados Unidos; la tasa de mortalidad fue de 21,1 x 1 000 000, y para estimarla se tuvieron en cuenta los decesos intra y extrahospitalarios. Si bien la disección aórtica es más frecuente en varones, entre los fallecidos prevalece el sexo femenino, en una proporción de 3:1.(6,7)
La fibrilación ventricular es una complicación rara y de extrema gravedad en pacientes con disección aórtica; su mortalidad prehospitalaria es alta. En 22 % de los enfermos puede aparecer como manifestación terminal de síndromes aórticos avanzados con compromiso coronario, taponamiento cardíaco, desequilibrios hidroelectrolíticos, o afecciones renales.(8)
La muerte súbita cardiovascular es el fallecimiento cuyas causas se presumen cardíacas, ocurrido en el lapso de una hora posterior al inicio de los síntomas, o en las primeras 24 horas posteriores a la última observación de un paciente presumiblemente saludable o con sintomatología de evolución favorable en apariencia. En Estados Unidos la incidencia aproximada de muerte súbita es de 350 000 casos al año, y la sobrevida está por debajo de 10 %. La fibrilación ventricular y la taquicardia ventricular monomórfica son las explicaciones más frecuentes, detectadas en 22 % de los pacientes.(9)
En Cuba no existen estudios epidemiológicos actualizados sobre la relación causal entre la disección aórtica y la fibrilación ventricular. Tampoco informes de casos con la complejidad del presente. En el cual la disección se extendió a la arteria ilíaca común derecha y afectó la renal derecha en el trayecto, con dificultades añadidas al procedimiento quirúrgico. De ahí que el objetivo de esta publicación sea describir un caso inusual de disección aórtica, y muerte súbita por fibrilación ventricular.
Paciente masculino, caucásico, de 55 años de edad, con antecedentes patológicos personales de hipertensión arterial de 20 años de evolución. Es consumidor habitual de café. Tiene tratamiento antihipertensivo, pero en la anamnesis manifestó haber sufrido descompensaciones frecuentes los días previos. Acudió al consultorio médico de la familia el 8 de abril de 2025, porque la semana anterior presentó dolor retroesternal intenso, de inicio súbito, ardoroso y desgarrante, que no se alivió con nitratos ni se modificó en estado de reposo. Este dolor se irradió a la región interescapular y en ocasiones a la lumbar, con disnea de esfuerzo y debilidad muscular.
El paciente perdió la conciencia de forma súbita, y se recuperó espontáneamente a los pocos minutos sin signos de secuelas neurológicas. Su tensión arterial era 180/110 mm Hg; lo cual motivó que se le trasladara al Hospital Clínico Quirúrgico “Hermanos Ameijeiras”.
El paciente firmó el documento de consentimiento informado antes de la realización del procedimiento quirúrgico, y aceptó la divulgación de su caso con fines científicos, siempre que se resguardase debidamente su información personal. El Comité de Ética de la Investigación de la institución aceptó la publicación del informe de caso.
El paciente cooperó durante la realización de los exámenes y el posoperatorio, hasta el momento de la pérdida de conciencia previa al fallecimiento.
En el examen físico se constató que el paciente tenía un índice de masa corporal de 36 Kg/m2 (obesidad grado II). Su frecuencia respiratoria era 24 inspiraciones por minuto, la cardíaca 98 latidos por minuto. La tensión arterial en el brazo derecho era 190/110 mm Hg, y en el izquierdo 150/90 mm Hg; los pulsos radiales eran asincrónicos. No se detectaron otras alteraciones durante la palpación y percusión. En la auscultación se escucharon sonidos crepitantes finos bibasales, ruidos cardíacos rítmicos (el primero de tono normal, el segundo disminuido). Se encontró un soplo mesosistólico de intensidad III/VI en el foco aórtico, con irradiación panfocal, y arrastre diastólico ligero (intensidad II/VI).
Al paciente se le realizaron exámenes complementarios de laboratorio, y se contrastaron sus resultados con los valores normales de referencia (expuestos aquí entre paréntesis). Hematocrito: 44 % (40-50 %); hemoglobina: 14,5 g/dL (13-16 g/dL); leucograma: 9,2 x 109/L (5-10 x 109/L); glucemia en ayunas: 6,2 mmol/L (5,2-6,9 mmol/L); creatinina: 112 μmol/L (60-114 μmol/L); grupo sanguíneo: O positivo (O+).
Los exudados nasal y faríngeo con antibiograma, urocultivo, hemocultivo, antígeno de superficie para el virus de hepatitis B, y la detección de anticuerpos para virus de hepatitis C, tuvieron resultados negativos.
En el ecocardiograma se observó el ventrículo izquierdo sin dilatación, con hipertrofia ligera y motilidad global conservada. Las válvulas presentaron cambios degenerativos, fundamentalmente la aórtica trivalva. La raíz aórtica estaba dilatada por el colgajo íntimo, móvil (visto como imagen de ecogenicidad baja); en sístole, este se desplazaba hacia la pared, y en diástole hacia el anillo valvular. El chorro de regurgitación era moderado, central, limitado por la interposición del colgajo íntimo.
El ventrículo izquierdo presentó un patrón de relajación pseudonormal, y el del flujo pulmonar era tipo II. Se vio además un derrame pericárdico posterior, ligero. No se encontraron trombos intracavitarios. La aorta midió 52 mm; la aurícula izquierda 44 mm; el ventrículo izquierdo 50/31 mm; el tabique interventricular 11 mm; la pared posterior 11 mm. El tiempo de aceleración de la arteria pulmonar fue de 100 ms; y la fracción de eyección ventricular izquierda de 68 % (Fig. 1).
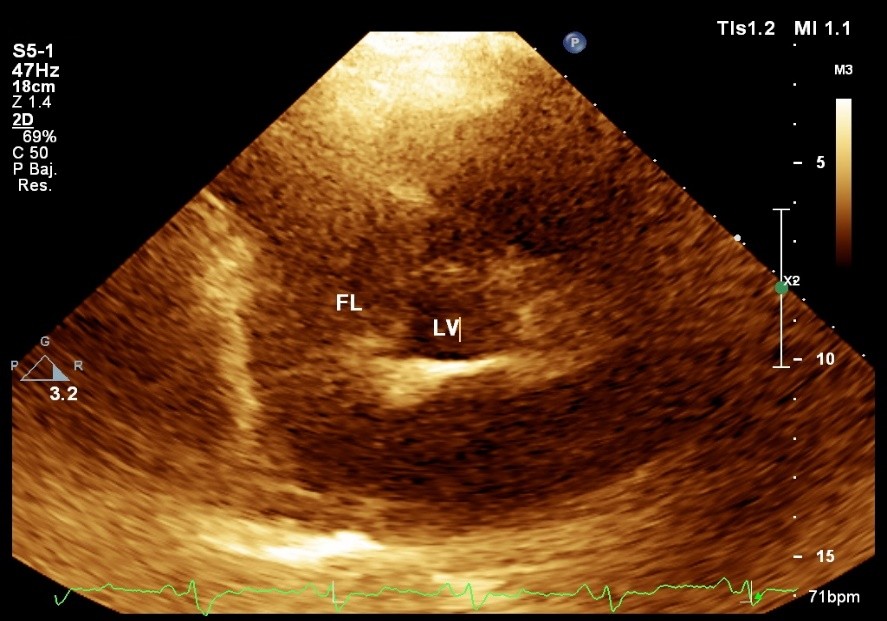
Fig. 1 – Ecocardiograma de vasos grandes, en eje corto paraesternal. Obsérvense la luz falsa aórtica, y la verdadera.
En la tomografía con cortes axial y coronal se observó el colgajo íntimo que dividía la luz aórtica en falsa y verdadera, aunque sin ocluirla. La disección comprometía la aorta ascendente, el arco aórtico, y aorta abdominal, y se extendía a las arterias renal derecha e ilíaca ipsilateral. Se constató derrame pericárdico leve (Fig. 2-4).
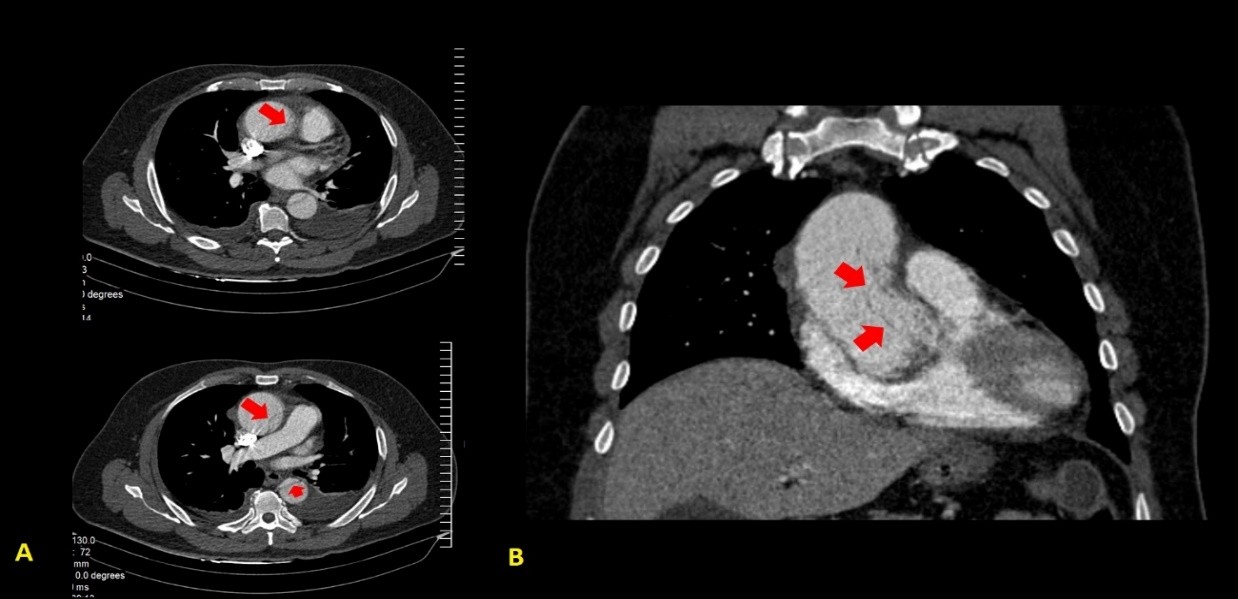
Fig. 2 - Tomografía axial computarizada de tórax. Cortes axial (A) y coronal (B). Obsérvese el colgajo íntimo (marcado con flechas rojas), concordante con la disección aórtica(I en la clasificación de DeBakey; A en la de Stanford).
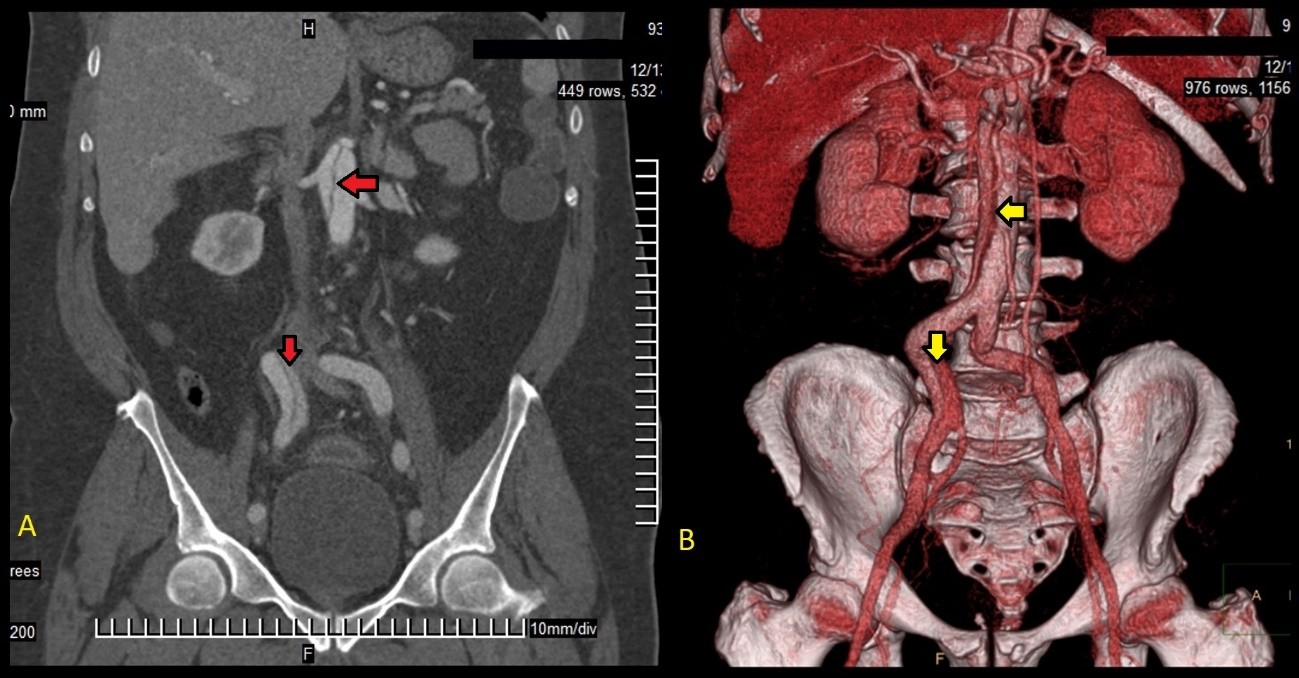
Fig. 3 -Comparación entre la tomografía abdominal en corte coronal (A) y la reconstrucción tridimensional mediante tomografía angiográfica contrastada (B). Obsérvese el recorrido disecante (flechas rojas en A y amarillas en B).
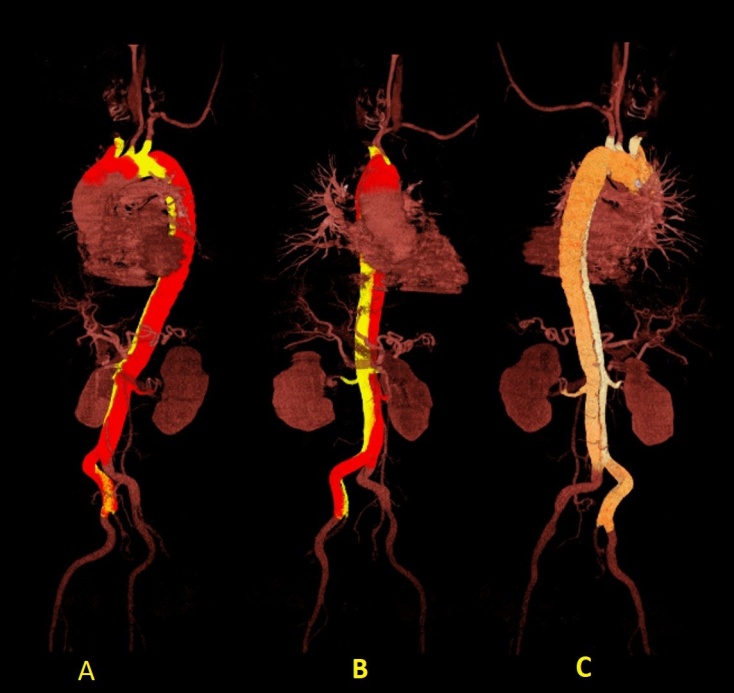
Fig. 4 - Reconstrucción angiotomográfica del recorrido de la disección (en A y B, en color amarillo; en C, blanco).
A partir de la sintomatología del paciente y los exámenes imagenológicos, se le diagnosticó disección aórtica tipo A de Stanford (I, en la clasificación de DeBakey), con prolongación anterógrada, y compromiso (en el trayecto) de las arterias ilíaca común derecha y renal ipsilateral. Debido a la complejidad de la afección y las probabilidades altas de complicaciones, se discutió el caso con los cirujanos cardiovasculares, y se programó la intervención quirúrgica de urgencia.
Se realizaron los procedimientos de asepsia y antisepsia previos a la intervención quirúrgica. Se diseccionaron la arteria y la vena femoral izquierdas; se colocaron una cánula específica en la arteria, y otra –que alcanzó la aurícula derecha– en la vena femoral. Otras cánulas se ubicaron en la vena cava superior y en la arteria pulmonar superior derecha, para colocar el ventilador pulmonar; el procedimiento se ejecutó sin complicaciones. Se realizó esternotomía media, y posteriormente pericardiotomía parietal. Se observó que el pericardio parietal estaba adherido al visceral en toda su extensión y engrosado (pericarditis).
En ese momento de la intervención quirúrgica, el paciente sufrió fibrilación ventricular (verificada en el monitor). Se procedió a la desfribrilación (con carga a 30 J). Se pinzó la aorta ascendente y se suministró cardioplejia hemática normotérmica por la raíz aórtica; con ello se consiguió la parada cardíaca. Por encima de los orificios (ostia arteriosum) se identificaron ambas paredes de la aorta proximal, las cuales se trataron con cola biológica. El interior y el exterior de la aorta se aseguraron con bandas de teflón. Se implantó un tubo de dacrón, en posición proximal, y se comprobó que la aorta ascendente fuese competente y la anastomosis no presentase sangrado.
Se colocó el separador en la anastomosis de la aorta distal para ver bien sus paredes, y tratarla con cola biológica y bandas de teflón. Se hizo una anastomosis distal con el conducto, en el cual se introdujo una aguja para extraer el aire, y se retiró la pinza aórtica. El corazón recuperó el ritmo sinusal de forma espontánea. Una vez comprobada la ermeticidad de la anastomosis, se procedió a la hemostasia. Se insertaron drenajes al mediastino y la pleura izquierda, y dos cables para un marcapasos externo. Se retiraron las cánulas femorales, y se efectuó el cierre arteriovenoso posterior, hasta la piel. El paciente fue trasladado a terapia intensiva cardiovascular para recibir los cuidados posquirúrgicos.
El estado del paciente evolucionó favorablemente hasta transcurridas 18 horas de la intervención quirúrgica, cuando sufrió pérdida súbita de la conciencia. No tenía pulsaciones periféricas, y el monitor registró un ritmo de fibrilación ventricular. Se efectuó desfibrilación dos veces; la segunda, presentó asistolia. Las maniobras de reanimación –que incluyeron administración de un ámpula de epinefrina (1 mg), en bolo endovenoso cada tres o cinco minutos– fueron infructuosas. Pasados 30 minutos, se declaró el fallecimiento.
La disección aórtica se clasifica en tipos, según criterios variados. Svenson lo hace de acuerdo al mecanismo fisiopatológico: el tipo I es la disección clásica con rotura primaria de la íntima (84 % de los casos); el II, el hematoma intramural (6 %); el III, una lesión disecante leve, sin hematoma (menos de 2 %); el IV, la úlcera ateroesclerótica perforante (10 %); y el V es la disección de la íntima por lesión traumática iatrogénica.(1,2)
Por su parte, Stanford y DeBakey, basan sus clasificaciones en las localizaciones y afectaciones anatómicas de las lesiones. Según Stanford, el tipo A disecciona la aorta ascendente; el B no, aunque sí el arco aórtico parcialmente.(1,10) Para DeBakey la disección tipo I se origina en la aorta ascendente y se extiende a la descendente, con afectación del arco aórtico; el II, aparece en la aorta ascendente y compromete el arco aórtico sin afectar la descendente. El III, en la aorta descendente pero no alcanza la porción ascendente o el arco aórtico; este tipo se subdivide en IIIa (afecta sólo el segmento torácico) y IIIb (compromete los segmentos torácico y abdominal).(1,2)
Las disecciones aórticas también se clasifican de acuerdo a las líneas temporales de inicio de sus sintomatologías y, consecuentemente, de sus diagnósticos. La hiperaguda o en fase crítica, en un lapso de 24 horas tras la aparición de los síntomas. La aguda, en los primeros 15 días. La subaguda entre 15 y 90 días. Y la crónica tras más de 90 días.(1,2,4)
Entre los principales factores de riesgo de la disección aórtica, se destacan el sexo masculino y la edad avanzada; no obstante 70 % de los pacientes padecen hipertensión arterial. Otras enfermedades inflamatorias aórticas vinculadas a la afección son: sífilis, arteritis de Takayasu, enfermedad de Behcec y arteritis de células gigantes. Procesos fisiológicos como el embarazo y el trabajo de parto pueden favorecer su aparición. Igualmente, los traumas debidos a accidentes (desaceleración) o intervenciones quirúrgicas (cateterismo aórtico, reemplazos aórtico o mitral, derivaciones coronarianas, e inserciones percutáneas de implantes intraluminales).(3,11)
El paciente no tenía edad avanzada, pero se identificaron en él otros factores de riesgo determinantes para la disección aórtica: sexo masculino, e hipertensión arterial como agravante. De esta última consta que, en los días previos a su hospitalización, sufrió descompensación y debido a las cifras elevadas de tensión acudió a los servicios de salud.
El síntoma más frecuente de esta afección es el dolor de inicio súbito, muy intenso (descrito como punzante, desgarrante, o en “puñalada”), localizado en la región torácica anterior (80-84 % son disecciones aórticas tipo A de Stanford) o predominantemente dorsal (64 % son tipo B). Este dolor puede irradiarse a la región torácica posterior (espalda), y sus zonas lumbar o abdominal, según las afectaciones anatómicas de la disección.(12,13)
Otros síntomas cardiovasculares son asimetría de pulsos, y pseudohipotensión arterial (los pacientes sufren insuficiencia valvular aórtica, insuficiencia cardíaca, o arritmias ventriculares malignas debidas a choque cardiogénico, o compromisos coronario, renal o hidroelectrolítico). Menos de 10 % de los enfermos presentan sintomatología respiratoria, con derrame pleural, disnea o hemoptisis. Las manifestaciones neurológas son variadas: hemiplejia, polineuropatía, paraparesias (40 % de los casos) y síncope (9 %).(12,13)
Este paciente presentó síntomas típicos de disección aórtica: dolor característico, y síncope (el cual no es común). Se decidió su ingreso hospitalario a partir del cuadro clínico sugerente de la afección, y la descompensación de la tensión arterial. Los estudios hematológicos e imagenológicos –sobre todo estos últimos– fueron determinantes para diagnosticar de forma precisa la localización y extensión de la lesión.
En el diagnóstico de la disección aórtica es importante observar la sintomatología de los pacientes; también, realizar los exámenes complementarios de laboratorio. Pero se debe tener en cuenta que la certeza diagnóstica es eminentemente imagenológica, basada en técnicas de alta resolución. La angiotomografía computarizada es la más efectiva para la detección de síndromes aórticos, debido a su disponibilidad, rapidez de ejecución, sensibilidad (88 %), y especificidad (98 %). Mediante esta técnica se puede observar la aorta en toda su extensión, identificar el colgajo íntimo, diferenciar la luz verdadera de la falsa, localizar los sitios de entrada y salida, evaluar la extensión de la disección a otras ramas arteriales, y prever las complicaciones asociadas.(14)
En el examen imagenológico de este paciente se emplearon el ecocardiograma, la angiotomografía computarizada multicorte, y la reconstrucción tridimensional de la imagen tomográfica. Sus resultados, y la valoración de la sintomatología, fueron concluyentes para diagnosticar una disección aórtica originada en la aorta ascendente, que afectó la arteria renal ipsilateral en su recorrido y se extendió a la ilíaca común derecha. Esta lesión se caracterizó como tipo A de Stanford (I en las clasificaciones de DeBakey y Svenson). En estos casos, la intervención quirúrgica es de urgencia.(1,2)
El tratamiento más efectivo para la disección aórtica tipo A de Stanford es la reparación quirúrgica abierta. Su carácter urgente se debe al riesgo de desenlace fatal elevado de esta lesión (aproximadamente 1 % cada una hora que se posponga la operación). En el procedimiento se resecciona el sitio de entrada primaria; la reconstrucción de la aorta ascendente abarca toda la extensión de la disección hasta la raíz aórtica. Las estrategias quirúrgicas pueden ser: reemplazo supracoronario de la aorta ascendente y preservación valvular (técnica de David), sustitución completa de la raíz aórtica (técnica de Bentall), reemplazo parcial o total del arco, o uso de trompa de elefante congelada (en casos específicos).(2) Para intervenir a este paciente se escogió la técnica de David.
Hondares-Guzmán y cols.(15) estudiaron 94 pacientes operados de aneurismas disecantes que afectaron sus aortas abdominales. La mayoría era masculina, blanca, y mayor de 60 años. Más de la mitad presentó complicaciones quirúrgicas: neumopatías inflamatorias, arritmias ventriculares malignas (taquicardia ventricular, fibrilación ventricular, o disociación electromecánica), trastornos hidroelectrolíticos, insuficiencias cardíaca y renal. Los investigadores constataron correlaciones positivas entre las complicaciones y la hipertensión o diabetes. La mayoría de los fallecimientos se debió complicaciones cardiovasculares; entre ellas, las taquiarritmias.
La asociación de la disección aórtica y la fibrilación ventricular es poco frecuente. Por ello en la literatura médica no se encuentran metaanálisis de informes de casos o estudios comparativos. En Cuba las publicaciones sobre el tema son escasas. Todo ello son limitaciones de la presente investigación.
La evolución de la disección aórtica es rápida y tórpida; por tanto, es una emergencia. De las técnicas de imagen imprescindibles en su diagnóstico, la tomografía angiográfica es el estándar de oro. El tratamiento suele ser quirúrgico abierto, con o sin reemplazo valvular aórtico. Este caso aportó evidencias diagnósticas e imagenológicas singulares sobre la disección aórtica, y los compromisos renal o electrolítico como causas de fibrilación ventricular. Esta última es una complicación infrecuente pero letal.
1. WC Members; Isselbacher EM, Preventza O, Hamilton Black III J, Augoustides JG, Beck AW, Bolen MA, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease. A report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. J Thorac Cardiovasc Surg [Internet]. 2023 [citado 20 May 2025];166(5):e182-331. Disponible en: https://pmc.ncbi.nlm.nih.gov/articles/PMC10784847/pdf/nihms-1953960.pdf
2. Czerny M, Grabenwöger M, Berger T, Aboyans V, Della Corte A, Chen EP, et al. EACTS/STS Guidelines for diagnosing and treating acute and chronic syndromes of the aortic organ. Ann Thorac Surg. [Internet]. Jul 2024 [citado 20 May 2025];118(1):5-115. Disponible en: https://www.annalsthoracicsurgery.org/action/showPdf?pii=S0003-4975%2824%2900077-8
3. Gouveia e Melo R, Mourão M, Caldeira D, Alves M, Lopes A, Duarte A, et al. A systematic review and meta-analysis of the incidence of acute aortic dissections in population-based studies. J Vasc Surg [Internet]. Feb 2022 [citado 20 May 2025];75(2):709-20. Disponible en: https://www.jvascsurg.org/action/showPdf?pii=S0741-5214%2821%2902132-7
4. Mac Gillivray TE, Gleason TG, Patel HJ, Aldea GS, Bavaria JE, Beaver TM et al. The Society of Thoracic Surgeons/American Association for Thoracic Surgery clinical practice guidelines on the management of type b aortic dissection. Ann Thorac Surg [Internet]. Abr 2022 [citado 21 May 2025];113(4):1073-92. Disponible en: https://zyicu.cn/wordpress/wp-content/uploads/2022/02/PIIS0003497521019743.pdf
5. Hiratzka LF, Bakris GL, Beckman JA, Bersin RM, Carr VF, Casey DE, et al. 2010 ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM Guidelines for the diagnosis and management of patients with thoracic aortic disease. A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines, American Association for Thoracic Surgery, American College of Radiology, American Stroke Association, Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, Society of Interventional Radiology, Society of Thoracic Surgeons,and Society for Vascular Medicine. J. Am Coll Cardiol [Internet]. 2010 [citado 23 May 2025];55(14):e27-129. Disponible en: https://www.sciencedirect.com/science/article/pii/S0735109710007151
7. Teurneau-Hermansson K, Ede J, Larsson M, Linton G, Von Rosen D, Sjögren J, et al. Mortality after non-surgically treated acute type A aortic dissection is higher than previously reported. Eur J Cardiothorac Surg [Internet]. 2024 [citado 23 May 2025];65(2):e039. Disponible en: https://pmc.ncbi.nlm.nih.gov/articles/PMC10871943/pdf/ezae039.pdf
8. Carson W, Tseng YZ, Chu SH. Emergency vectorcardiographic study of acute aortic dissection. Am J Emerg Med [Internet]. May 2003 [citado 23 May 2025];21(3):184-8. Disponible en: https://www.sciencedirect.com/science/article/abs/pii/S0735675702422462
9. Pardo J, Sepúlveda J, Lira G, Pérez A, Dighero B, Herrera M, et al. Muerte súbita por fibrilación ventricular en deportista. Una presentación inusual del síndrome de Brugada. Caso clínico. Rev. méd. Chile [Internet]. Jun 2021 [citado 2025 Jun 30];149(6):939-44. Disponible en: https://www.scielo.cl/pdf/rmc/v149n6/0717-6163-rmc-149-06-0939.pdf
10. Uimonen M. Synthesis of multidimensional pathophysiological process leading to type A aortic dissection: a narrative review. J Thorac Dis [Internet]. Oct 2021 [citado 26 May 2025];13(10):6026-36. Disponible en: https://pmc.ncbi.nlm.nih.gov/articles/PMC8575841/pdf/jtd-13-10-6026.pdf
11. Levy D, Sharma S; Grigorova Y; Farci F, Le JK. Aortic dissection. En: StatPearls [Internet]. Treasure Island (FL): Stat Pearls Publishing; 2024 [citado 26 May 2025]. Disponible en: https://www.statpearls.com/point-of-care/20603
12. Lidén K, Jonsson M, Stackelberg O, Steuer J, Krasun M, Smedberg C. Acute symptomatic isolated abdominal aortic dissection - clinical characteristics, outcome, and sex differences. Ann Vasc Surg [Internet]. Sep 2024 [citado 26 May 2025];106:61-70. Disponible en: https://www.sciencedirect.com/science/article/pii/S089050962400205X
13. Gaul C, Dietrich W, Friedrich I, Sirch J., Erbguth FJ. Neurological symptoms in type A aortic dissection. Stroke [Internet]. Feb 2007 [citado 26 May 2025];38(2):292-7. Disponible en: https://www.ahajournals.org/doi/pdf/10.1161/01.STR.0000254594.33408.b1?download=true
14. Goldstein SA, Evangelista A, Abbara S, Arai A, Asch FM, Badano LP, et al. Multimodality imaging of diseases of the thoracic aorta in adults: from the American Society of Echocardiography and the European Association of Cardiovascular Imaging: endorsed by the Society of Cardiovascular Computed Tomography and Society for Cardiovascular Magnetic Resonance. J Am Soc Echocardiogr [Internet]. Feb 2015 [citado 28 May 2025];28(2):119-82. Disponible en: https://www.sciencedirect.com/science/article/pii/S0894731714008591
15. Hondares-Guzmán MC, Tuero-Maruri CE, Triana-Mantilla ME, Hernández-Seara A, Viña-Cisneros H. Complicaciones posquirúrgicas en pacientes con aneurisma de la aorta abdominal operados electivamente. Rev Cubana Angiol Cir Vasc [Internet]. Ago 2021 [citado 28 May 2025];22(2):e278. Disponible en: http://scielo.sld.cu/pdf/ang/v22n2/1682-0037-ang-22-02-e278.pdf
Conflictos de intereses
Los autores declaran que no existen conflictos de intereses.
Contribución de autoría
Yander Luis Izaguirre-Campillo: conceptualización, curación de datos, análisis formal, investigación, metodología, supervisión, validación, visualización y redacción del borrador original.
Melissa Hernández-Cardoso: conceptualización, curación de datos, investigación, metodología, administración del proyecto, recursos, validación y visualización.
Luis Alejandro Wong-Pitty: recursos, software, supervisión, validación, visualización, redacción del borrador original.
Financiación
Hospital Clínico Quirúrgico “Hermanos Ameijeiras”. La Habana, Cuba.
 Esta obra está bajo una licencia Creative Commons Atribution 4.0/International/Deed
Esta obra está bajo una licencia Creative Commons Atribution 4.0/International/Deed