

Informe de caso
Presentación atípica de tumor renal con pielonefritis y trombosis venosa profunda en miembro inferior. Informe de caso
Atypical presentation of a renal tumor with pyelonephritis and deep vein thrombosis in the lower limb. Case report
Lilibet Muñoa-Garrido1*  https://orcid.org/0009-0002-5682-1193
https://orcid.org/0009-0002-5682-1193
Julio Michel Arias-Manganelly2  https://orcid.org/0000-0003-0223-8509
https://orcid.org/0000-0003-0223-8509
Reinaldo Enrique Díaz-González3  https://orcid.org/0009-0007-8842-7226
https://orcid.org/0009-0007-8842-7226
1Especialista de Primer Grado en Medicina Interna. Profesor Instructor. Aspirante a Investigador. Universidad de Ciencias Médicas de Camagüey, Filial de Ciencias Médicas de Nuevitas. Hospital General Docente “Martín Chang Puga”, Nuevitas. Camagüey, Cuba.
2Especialista de Primer Grado en Cirugía General. Profesor Instructor. Investigador Agregado. Universidad de Ciencias Médicas de Camagüey, Filial de Ciencias Médicas de Nuevitas. Hospital General Docente “Martín Chang Puga”, Nuevitas. Camagüey, Cuba.
3Especialista de Primer Grado en Medicina Interna. Profesor Instructor. Universidad de Ciencias Médicas de Camagüey, Filial de Ciencias Médicas de Nuevitas. Hospital General Docente “Martín Chang Puga”, Nuevitas. Camagüey, Cuba.
*Autor para la correspondencia. Correo electrónico:  lilibet960@gmail.com
lilibet960@gmail.com
RESUMEN
Introducción: los tumores renales con presentaciones atípicas –como infecciones urinarias graves, o complicaciones tromboembólicas– son infrecuentes, y sus sintomatologías se asemejan a las de otras enfermedades; lo cual implica retos diagnósticos para los especialistas.
Objetivo: mostrar un paciente diagnosticado de tumor renal con manifestaciones atípicas (pielonefritis y trombosis venosa profunda en un miembro inferior), con énfasis en la dificultad del diagnóstico debida a la superposición de síntomas.
Presentación del caso: paciente masculino de 60 años de edad, piel negra, sin comorbilidades. Tres días antes de acudir a la consulta presentó toma del estado general, fiebre de 38-39 ºC, escalofríos, dolor lumbar moderado, y cambios de temperatura, aumento de volumen, y dolor en la pierna derecha. Durante el examen físico se constataron puntos costovertebrales posteriores positivos, dolor a la percusión, sin masas palpables, ni disuria o hematuria. En la pierna derecha se notaron los pulsos femoral, poplíteo, pedio, y tibial posterior. Se le diagnosticó carcinoma de células renales con compresión vascular, y fue ingresado. El urocultivo resultó positivo, y con la ecografía Doppler se confirmó la trombosis venosa profunda. Se le trató con antibióticos y anticoagulantes; la infección remitió y el edema disminuyó. Rechazó la intervención quirúrgica, por lo cual se le mantiene seguimiento por el oncólogo.
Conclusiones: este informe aportó evidencia científica sobre la interacción entre la enfermedad oncológica, la infección, y los síntomas vasculares; este escenario inusual tiene implicaciones pronósticas críticas. De ahí la importancia de considerar diagnósticos diferenciales amplios en pacientes con hallazgos atípicos, y su atención multidisciplinaria.
Palabras clave: carcinoma de células renales; diagnóstico diferencial; infecciones urinarias; informes de casos; pielonefritis; trombosis de la vena.
ABSTRACT
Introduction: renal tumors with atypical presentations—such as severe urinary infections or thromboembolic complications—are uncommon, and their symptoms resemble those of other diseases, which poses diagnostic challenges for specialists.
Objective: to present a patient diagnosed with a renal tumor with atypical manifestations (pyelonephritis and deep venous thrombosis in a lower limb), emphasizing the difficulty of diagnosis due to overlapping symptoms.
Case presentation: a 60-year-old black male patient, with no comorbidities. Three days prior to consultation, he developed general malaise, fever of 38–39 °C, chills, moderate lumbar pain, and temperature changes, along with increased volume and pain in the right leg. Physical examination revealed positive posterior costovertebral angle tenderness and percussion pain, with no palpable masses, dysuria, or hematuria. In the right leg, the femoral, popliteal, dorsalis pedis, and posterior tibial pulses were present. He was diagnosed with renal cell carcinoma with vascular compression and was admitted. The urine culture tested positive, and Doppler ultrasound confirmed deep venous thrombosis. He was treated with antibiotics and anticoagulants; the infection resolved and the edema decreased. He declined surgical intervention; therefore, continued follow-up by the oncologist was maintained.
Conclusions: this report provides scientific evidence on the interaction between oncologic disease, infection, and vascular symptoms; this unusual scenario carries critical prognostic implications. Hence the importance of considering broad differential diagnoses in patients with atypical findings, as well as ensuring multidisciplinary care.
Keywords: case reports; differential diagnosis; pyelonephritis; renal cell carcinoma; urinary tract infections; venous thrombosis.
Recibido: 06/05/2025
Aprobado: 14/10/2025
Publicado: 05/11/2025
El carcinoma de células renales o hipernefroma se origina en los túbulos proximales de las nefronas. Representa aproximadamente 90 % de los casos de cáncer renal en adultos.(1,2)
Los tumores renales con presentaciones atípicas –como infecciones urinarias graves, o complicaciones tromboembólicas– son infrecuentes, y sus sintomatologías se asemejan a las de otras enfermedades; lo cual implica retos diagnósticos para los especialistas. Se han documentado pacientes con masas renales, enmascaradas como pielonefritis aguda o asociadas a trombosis venosa profunda; en tales casos, los diagnósticos y tratamientos –que debieran ser oportunos– suelen retrasarse. Si bien este es un fenómeno raro, es importante valorar desde un enfoque multidisciplinario aquellos pacientes con síntomas urológicos y vasculares concurrentes.(3,4)
De ahí que el objetivo de este artículo sea presentar un paciente diagnosticado de tumor renal con manifestaciones atípicas (pielonefritis y trombosis venosa profunda en un miembro inferior), con énfasis en la dificultad del diagnóstico debida a la superposición de síntomas.
Paciente masculino de 60 años de edad y piel negra. Originario de la Habana, se encontraba temporalmente en el municipio Nuevitas por su trabajo como estibador en la Fábrica de Cemento. Refirió ser soltero, sin hijos, con su madre aún viva y el padre fallecido 10 años atrás. Su horario laboral era exigente, y el descanso en ocasiones insuficiente. Llevaba una dieta irregular, con antecedentes de salud, sin operaciones previas ni traumatismos.
El estudio fue aprobado por el Comité de Ética del Hospital General Docente “Martín Chang Puga” de Nuevitas, Camagüey, mediante el acta número 2 (de 5 de febrero de 2025). El paciente firmó el consentimiento informado, tras comprender los objetivos y alcances de la publicación de su caso y las imágenes correspondientes con garantías de anonimato. Se omitieron los datos identificativos personales, y se usaron códigos para garantizar la confidencialidad de la información.
PERSPECTIVA DEL PACIENTE
El paciente se mostró satisfecho y agradecido con la atención del personal médico que lo atendió.
Cuando el paciente acudió a consulta, hacían aproximadamente tres días que presentaba toma del estado general, fiebre de 38-39 ºC (que cedía una vez administrada dipirona por vía oral), escalofríos, dolor lumbar de intensidad moderada. También, cambios de temperatura, aumento de volumen, y dolor en la pierna derecha.
Durante el examen físico el paciente presentó una facies dolorosa, frecuencia cardíaca de 75 latidos por minuto, sin soplos, frecuencia respiratoria de 20 respiraciones por minuto, saturación de oxígeno en 98 %, tensión arterial de 130/80 mm Hg, y temperatura axilar de 37,5 ºC. Al examinar el sistema genitourinario se constató un aumento de volumen leve en la fosa lumbar derecha; no se observaron cicatrices, eritema o edema cutáneo en región suprapúbica. Se detectaron puntos pielorenoureterales posteriores dolorosos. La percusión en la región lumbar derecha fue positiva, y no se pudo palpar el riñón derecho en la posición de decúbito supino; no se notaron soplos abdominales.
En el examen del sistema venoso periférico se constató aumento de volumen (edema) en la pierna derecha, con cambios de temperatura localizados (piel caliente al tacto). No se observaron signos de insuficiencia venosa crónica, y el signo de Homans resultó negativo (el paciente no sintió dolor durante la dorsiflexión del pie). Se le diagnosticó carcinoma de células renales con compresión vascular, por lo cual se decidió ingresarlo.
Se le hicieron exámenes complementarios hematológicos y hemoquímicos, ultrasonidos abdominal y renal, y ultrasonido Doppler con compresión venosa. En el electrocardiograma de 12 derivaciones no se encontraron cambios eléctricos, como tampoco alteraciones en la radiografía de tórax anteroposterior. La sintomatología del paciente mejoró tras el tratamiento con antimicrobianos, analgésicos, antipiréticos, y anticoagulantes. Ante la posibilidad de tratar quirúrgicamente el tumor, su respuesta fue negativa.
El paciente estuvo hospitalizado durante cinco días. Al momento del ingreso se le indicaron los exámenes complementarios, y se inició tratamiento con ceftriaxona (1g intravenoso cada 12 horas, por sospecha de pielonefritis), paracetamol (500 mg cada ocho horas para controlar la fiebre y el dolor), heparina sódica (5 000 unidades subcutáneas cada cuatro horas, por la trombosis venosa profunda confirmada). En el ultrasonido se observó una masa renal con apariencia de carcinoma de células renales. Se discutieron los riesgos y beneficios de la biopsia y la intervención quirúrgica.
El segundo día se obtuvieron los resultados de los exámenes de laboratorio. Se ajustó la fluidoterapia para proteger la función renal, y se monitoreó el sangrado por el uso de heparina. El enfermo no presentó complicaciones.
Al tercer día se constató que el cuadro sintomático del paciente evolucionó favorablemente, con reducción de la fiebre y el dolor. Persistió el edema en la pierna derecha. En el colectivo de especialistas se discutió la posibilidad de una intervención quirúrgica, y se recomendó realizar una tomografía axial computarizada. La institución no dispone de este medio diagnóstico, por lo cual se sugirió derivar al paciente a un centro de salud terciario; su respuesta fue negativa. Se continuó el esquema de tratamiento con antimicrobiano y anticoagulante; y se añadió omeprazol (40 mg diarios, como profilaxis del sangrado gástrico).
El cuarto día se le indicó al paciente un electrocardiograma, en el cual no se encontraron arritmias. Durante el ultrasonido Doppler con compresión venosa se confirmó una trombosis venosa profunda en la pierna derecha. El paciente insistió en que fuese tratado de forma conservadora, por temor a las complicaciones.
El quinto día se preparó al paciente para el egreso hospitalario y su seguimiento en las consultas de oncología y urología del Hospital Provincial de Camagüey. Se constató su estabilidad hemodinámica y analítica. Se confeccionó el resumen de historia clínica, en el cual se indicó controlar el tiempo de protrombina a los siete días mediante el índice internacional normalizado (INR, por sus siglas en inglés), para verificar que se mantuviese en el rango de 2,0-3,0. El seguimiento por el urólogo tenía el objetivo de reevaluar el estado de la masa renal (para ello, la opción era la realización de la tomografía axial computarizada en una institución terciaria). El paciente refirió sentirse bien y rechazó nuevamente la posibilidad de una intervención quirúrgica. Se enfatizó en mantener la observación sobre los síntomas de progresión tumoral (hematuria, y pérdida de peso).
Al equipo médico se le recomendó documentar los rechazos del paciente, mediante el registro –en la historia clínica– de sus negativas a la realización de la tomografía axial computarizada y la intervención quirúrgica, así como la información que se le proporcionó sobre los riesgos inherentes a ello. También, abordar el caso con un enfoque psicosocial. Por lo cual se vio aconsejable derivar al paciente a las consultas de psicología y oncología, con el objetivo de concientizarlo sobre la necesidad de adherencia a los tratamientos futuros. En caso de progresión tumoral, tener en cuenta la necesidad de actualización terapéutica (valorar la posibilidad de la inmunoterapia, si fuese accesible en el sistema de salud).
En el estado del paciente, con su negativa a ser intervenido quirúrgicamente, se estimó una supervivencia de cinco años. Se tuvo en cuenta que esta suele estar entre 50-70 % en enfermos con tumores localizados de menos de 5 cm; en aquellos que presentan riesgo de metástasis es de 20 % a los dos años. En este caso, la trombosis venosa profunda es un factor de pronóstico malo; por estudios retrospectivos(5,6,18) se conoce que asociada a un carcinoma de células renales reduce la supervivencia global en 30 %.
Al paciente se le realizaron exámenes complementarios, cuyos resultados posibilitaron el diagnóstico. Hematocrito: 0,45 L/L; leucograma: 11,4 x 109/L; polimorfonucleares: 0,87 %; linfocitos: 0,13 %; eosinófilos: 0,02 %, tiempo de coagulación: siete minutos; tiempo de sangrado: un minuto; conteo de plaquetas: 200 x 109/L; glucemia: 4,8 mmol/L; creatinina: 85 µmol/L; triglicéridos: 0,8 mmol/L; colesterol: 4,1 mmol/L; proteínas totales: 68 g/L. En el examen general de orina se observaron leucocitos (900) y hematíes (60); no se encontraron cilindros.
Durante el ultrasonido Doppler espectral venoso del miembro inferior derecho, se encontró en la vena poplítea femoral una trombosis venosa profunda aguda, con material trombótico intraluminal hipoecogénico, incompresible del todo; no se vio flujo espontáneo. Se detectaron signos inflamatorios asociados: engrosamiento perivascular e hiperemia. La trombosis se extendía a las venas tibiales posteriores, sin flujo visible. En la vena safena magna derecha había reflujo venoso (signo de insuficiencia valvular secundaria). Los tejidos de la pierna estaban blandos, con edema subcutáneo marcado en la pantorrilla (más de tres centímetros de grosor, en comparación con el lateral contrario). El aumento de la temperatura local se relacionó con la hipervascularización perivascular.
En el ultrasonido abdominal se observaron: el hígado, de aspecto homogéneo y tamaño normal; la vesícula biliar distendida, sin litiasis; la vía biliar en buenas condiciones. El páncreas no se vio por la interposición de gases. Los riñones presentaban tamaño y forma normales, con buena relación córticomedular. En el polo inferior del riñón derecho se observó una imagen de masa heterogénea, mayormente ecogénica, de 104 x 90 mm, irregular y con bordes mal definidos, circunscrita parcialmente, sin cápsula ecogénica visible, en el parénquima (Fig. 1).
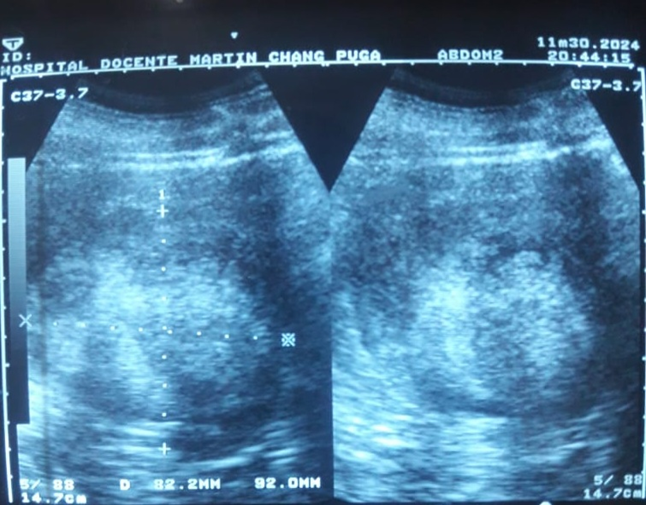
Fig. 1 - Ultrasonidos abdominal y renal simples. Obsérvese la masa heterogénea, ecogénica en su mayor parte, en el parénquima del riñón derecho.
Estas características correspondían a una neoplasia sólida (aquística), sin hidronefrosis, ni invasión vascular aparente (Fig. 2).
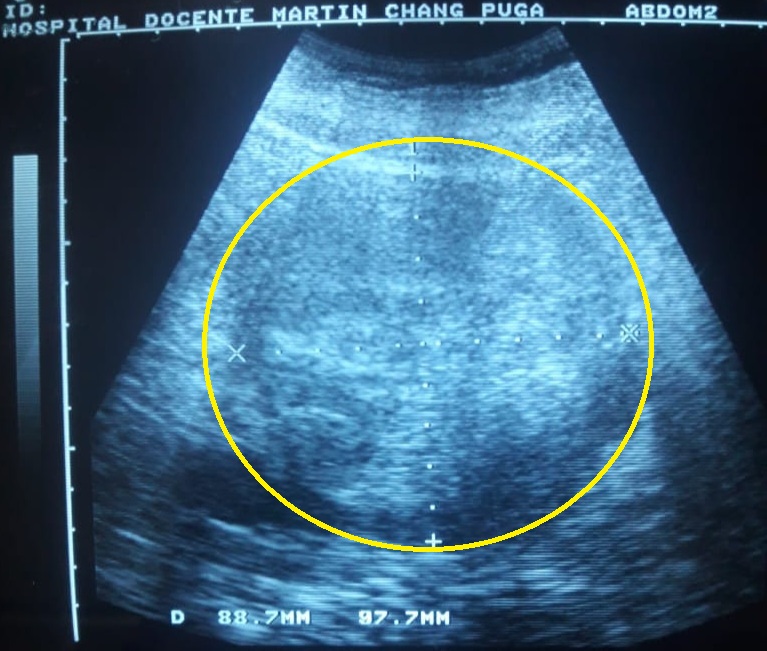
Fig. 2 - Ultrasonido abdominal. El círculo amarillo delimita la imagen del hipernefroma.
Debido a la imposibilidad de acceder a la tomografía axial computarizada, no se pudo confirmar la existencia de metástasis o estadificar el tumor (este dato es fundamental para indicar el tratamiento correcto).
En el diagnóstico diferencial inicial se tuvieron en cuenta dos posibles enfermedades: infección urinaria complicada (pielonefritis), o trombosis venosa profunda. Ello, de acuerdo a la sintomatología que presentaba el paciente: fiebre, dolor en el flanco, y edema.
Aproximadamente 20-30 % de los tumores renales se presentan en formas atípicas; las más comunes son los síndromes paraneoplásicos (10-40 %), hipertensión arterial, policitemia, hipercalcemia, síndrome de Stauffer, síntomas constitucionales por pérdida de peso inexplicable (30 %), fiebre idiopática (20 %), anemia (20-30 %), varicocele de aparición súbita (2-3 %), síndrome de la vena cava inferior (1-2 %), y metástasis iniciales (25-30 %, detectadas en el momento del diagnóstico).(4,5)
La incidencia del carcinoma de células renales varía significativamente entre los grupos étnicos. La tasa más alta (ajustada por edad) se registra en las poblaciones de Europa del este y Escandinavia (10-12/100 000); y las más bajas en personas de origen asiático (2-3/100 000) e hispano (4-5/100 000). Entre los afrodescendientes el riesgo de padecer esta enfermedad es 20-25 % mayor en comparación con los caucásicos.(6-9).
La mayor proporción de enfermos de carcinoma de células renales se encuentra en el grupo etario de 60-70 años, con predominio de los hombres. Los factores de riesgo para la aparición de estos tumores son el tabaquismo (20-30 % de los pacientes diagnosticados son fumadores), obesidad (especialmente en mujeres), hipertensión arterial, exposición ocupacional a cadmio, asbestos o derivados del petróleo, y enfermedad renal quística adquirida en la diálisis.(9,10)
La relación entre el carcinoma de células renales y las manifestaciones sistémicas (fiebre, anemia, y pérdida de peso) ha sido documentada ampliamente, aunque su fisiopatología no está elucidada. Se postula que la liberación de citoquinas inflamatorias como la interleucina-6 (IL-6) y el factor de necrosis tumoral (TNF-α) por el tumor, o la necrosis hística, podrían ser las causas de estos síntomas.(11)
En este caso, la fiebre podría atribuirse tanto a la masa renal primaria como a posibles micrometástasis no detectadas inicialmente. Existen estudios(12-14) que respaldan esta hipótesis con la evidencia de que 30 % de los enfermos de carcinoma de células renales y síndrome febril presentan enfermedad metastásica oculta. Por otra parte, la elección del ultrasonido como medio diagnóstico primario –a pesar de su menor sensibilidad comparado con la tomografía axial computarizada– se debió a las limitaciones de recursos propias del entorno institucional, en el cual la accesibilidad y el costo son determinantes.(15)
Desde una perspectiva epidemiológica, el caso de este paciente es relevante por tratarse de un afrodescendiente. Téngase en cuenta que entre esta población la incidencia de carcinoma de células renales es aproximadamente 1,5 veces superior respecto a la caucásica), los diagnósticos suelen hacerse en estadios avanzados de la enfermedad, y la supervivencia global es la más baja.(16) Estas disparidades se atribuyen a factores biológicos (polimorfismos en el gen VHL), barreras en el acceso a la atención sanitaria, y diferencias en la agresividad tumoral; por ello, se necesitan estrategias de detección precoz adaptadas a grupos minoritarios.(9, 12)
El diagnóstico oportuno del carcinoma de células renales es difícil, debido a su naturaleza asintomática en sus etapas primeras, y sus presentaciones atípicas; de ahí que 50-60 % de los enfermos son diagnosticados de forma incidental en estudios imagenológicos indicados por otras razones.(17)
Los especialistas deben tener en cuenta este diagnóstico, con un índice alto de sospecha, en aquellos pacientes con factores de riesgo (tabaquismo, obesidad, hipertensión arterial, diálisis), e indicar la ecografía abdominal en sus revisiones rutinarias. También, prestar atención a los cambios en los parámetros de los exámenes de laboratorio, y tener en cuenta las presentaciones atípicas de la enfermedad (la tríada clásica de hematuria, dolor, y masa palpable aparece sólo en 6-10 % de los casos, y es un indicio de enfermedad avanzada). Para hacer más efectivo el diagnóstico precoz los protocolos deberían incluir la observación de la hematuria; de modo que, a todos los pacientes mayores de 40 años con hematuria microscópica persistente, se les hagan exámenes imagenológicos, análisis de alerta, y seguimiento como grupos de riesgo.
Ante pacientes con los síntomas descritos, los médicos generales deben tener en cuenta la posibilidad de un carcinoma de células renales con presentación atípica. Si se detecta una masa renal, lo indicado sería derivar al enfermo de manera oportuna al servicio de urología. El intervalo promedio entre el inicio de los síntomas y el diagnóstico es de seis a 12 meses,(18) por lo cual reducir este tiempo es crucial para mejorar el pronóstico.
En este caso, hubo limitaciones para realizar la tomografía axial computarizada (examen que es el estándar de oro para la estadificación del tumor); lo cual imposibilitó valorar la existencia de metástasis locales o a distancia. Aunque el estudio ultrasonográfico tiene sensibilidad alta para masas renales mayores de 3 cm, es insuficiente para detectar ganglios linfáticos afectados.
El caso de este paciente evidenció la importancia de la pericia médica para tener en cuenta diagnósticos diferenciales atípicos, a partir de cuadros sintomáticos que no son característicos. Se confirmó lo reportado en la literatura sobre estos tumores, y se introdujo una perspectiva novedosa al describir una variante poco frecuente de la enfermedad a pesar de las limitaciones de medios diagnósticos. Se demostró tanto la necesidad de conformar e integrar protocolos para evitar complicaciones, como la importancia del enfoque clínico meticuloso en entornos con recursos limitados. Este informe aportó evidencia científica sobre la interacción entre la enfermedad oncológica, la infección, y los síntomas vasculares; este escenario, poco descrito, tiene implicaciones pronósticas críticas. Por ello, se alerta a la comunidad médica sobre la importancia de considerar diagnósticos diferenciales amplios en pacientes con hallazgos atípicos, y su atención multidisciplinaria.
1. Padala SA, Barsouk A, Thandra KC, Saginala K, Bhattarai M, Mohammed A, et al. Epidemiology of renal cell carcinoma. World J Oncol [Internet]. 2020 [citado 22 Mar 2025];11(3):79-87. Disponible en: https://pmc.ncbi.nlm.nih.gov/articles/PMC7239575/pdf/wjon-11-079.pdf
2. Motzer RJ, Jonasch E, Agarwal N, Alva A, Bagshaw H, Baine M, et al. NCCN Guidelines® insights: kidney cancer, version 2.2024. J Natl Compr Canc Netw. Feb 2024 [citado 27 Abr 2025];22(1):4-16. Disponible en: https://jnccn.org/downloadpdf/view/journals/jnccn/22/1/article-p4.pdf
3. Rose TL, Kim WY. Renal cell carcinoma. A review. JAMA [Internet]. Sep 2024 [citado 27 Abr 2025];332(12):1001-10. Disponible en: https://pmc.ncbi.nlm.nih.gov/articles/PMC11790279/pdf/nihms-2032282.pdf
4. Saber S, Ghosh PK, Alam MT, Yasmin N, Hossain MM, Alam RF. Atypical presentation of renal cell carcinoma: a case report. EJMHS [Internet]. Ene 2021 [citado 21 Mar 2025];3(1):8-10. Disponible en: https://ej-med.org/index.php/ejmed/article/download/650/364/2402
5. Ljungberg B, Albiges L, Abu-Ghanem Y, Bedke J, Capitanio U, Dabestani S, et al. European Association of Urology Guidelines on renal cell carcinoma: the 2022 update. Eur Urol [Internet]. Oct 2022 [citado 12 Mar 2025];82(4):399-410. Disponible en: https://www.researchgate.net/profile/Thomas-Lam-3/publication/359480805_European_Association_of_Urology_Guidelines_on_Renal_Cell_Carcinoma_The_2022_Update/links/623ec82357084c718b695141/European-Association-of-Urology-Guidelines-on-Renal-Cell-Carcinoma-The-2022-Update.pdf
6. Jonasch E, Walker CL, Rathmell WK. Clear cell renal cell carcinoma ontogeny and mechanisms of lethaly. Nat Rev Nephrol. [Internet]. Abr 2021 [citado 19 Mar 2025];17(4):245-61. Disponible en: https://pmc.ncbi.nlm.nih.gov/articles/PMC8172121/pdf/nihms-1692237.pdf
7. Capitanio U, Bensalah K, Bex A, Boorjian SA, Bray F, Coleman J, et al. Epidemiology of renal cell carcinoma. Eur Urol [Internet]. 2018 [citado 19 Mar 2025];75(1):74-84. Disponible en: https://pmc.ncbi.nlm.nih.gov/articles/PMC8397918/pdf/nihms-1730066.pdf
8. Rini BI, Battle D, Figlin RA, George DJ, Hammers H, Hutson T. The society for immunotherapy of cancer consensus statement on immunotherapy for the treatment of advanced renal cell carcinoma (RCC). J Immunother Cancer [Internet]. 2019 [citado 21 Mar 2025];7(1):354. Disponible en: https://pmc.ncbi.nlm.nih.gov/articles/PMC6924043/pdf/40425_2019_Article_813.pdf
9. Caño-Velasco J, Polanco-Pujol L, Hernández-Cavieres J, González-García FJ, Herranz-Amo F, Ciancio G, el al. Controversias en el diagnóstico del carcinoma de células renales con trombosis venosa asociada. Actas Urol Esp. [Internet]. 2021[citado 21 Mar 2025];45(4):257-63. Disponible en: https://www.elsevier.es/es-revista-actas-urologicas-espanolas-292-articulo-controversias-el-diagnostico-del-carcinoma-S0210480620302217
10. Powles T, Albiges L, Bex A, Comperat E, Grünwald V, Kanesvaran R, et al. Renal cell carcinoma: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol [Internet]. Ago 2024 [citado 27 Abr 2025];35(8):692-706. Disponible en: https://www.annalsofoncology.org/action/showPdf?pii=S0923-7534%2824%2900676-8
11. Ferraris F, Tobia-González IP, Jufe L, Bruno L, González C, Corona P, et al. Pautas de Cáncer renal 2024 Sociedad Argentina de Urología, Capítulo de Oncología. Rev. argent. urol [Internet]. 2024 [citado 27 Abr 2025];89(4):1-70. Disponible en: https://revistasau.org/index.php/revista/article/download/4551/3776
12. Alaghehbandan R, Siadat F, Trpkov K. What’s new in the WHO 2022 classification of kidney tumours? Pathologica [Internet]. 2023 [citado 27 Abr 2025];115(1):8-22. Disponible en: https://pmc.ncbi.nlm.nih.gov/articles/PMC10342217/pdf/pathol-2023-01-8.pdf
13. Alaghehbandan A, Pérez-Montiel D, Luis AS, Hes O. Molecular genetics of renal cell tumors: a practical diagnostic approach. Cancers (Basel) [Internet]. 2019 [citado 19 Mar 2025];12(1):85. Disponible en: https://pmc.ncbi.nlm.nih.gov/articles/PMC7017183/pdf/cancers-12-00085.pdf
14. Osawa T, Takeuchi A, Kojima T, Shinohara N, Eto M, Nishiyama H. Overview of current and future systemic therapy for metastatic renal cell carcinoma. Jpn J Clin Oncol. 2019;49(5):395-403.
15. Negussie F, Giru BW, Yusuf NT, Gela D. Psychological distress and associated factors among cancer patients in public hospitals, Addis Ababa, Ethiopia: a cross-sectional study. BMC Psychol [Internet]. 2023 [citado 1 Abr 2025];11(1):41. Disponible en: https://pmc.ncbi.nlm.nih.gov/articles/PMC9921361/pdf/40359_2023_Article_1079.pdf
16. Song X, Tian Y, Li H, Liu B, Zhang A, Hong Y. Research progress on advanced renal cell carcinoma. J Int Med Res [Internet]. Jun 2020 [citado 21 Feb 2025];48(6):0300060520924265. Disponible en: https://pmc.ncbi.nlm.nih.gov/articles/PMC7294379/pdf/10.1177_0300060520924265.pdf
17. Chen YW, Wang L, Panian J, Dhanji S, Derweesh I, Rose B, et al. Treatment landscape of renal cell carcinoma. Curr Treat Options Oncol [Internet]. Dic 2023 [citado 27 Abr 2025];24(12):1889-916. Disponible en: https://pmc.ncbi.nlm.nih.gov/articles/PMC10781877/pdf/11864_2023_Article_1161.pdf
18. Tra J, Ornstein MC. Clinical review on the management of metastatic renal cell carcinoma. JCO Oncol Pract [Internet]. 2021 [citado 22 Ene 2025];18(3):187-96. Disponible en: https://ascopubs.org/doi/pdfdirect/10.1200/OP.21.00419
Conflicto de intereses
Los autores declaran que no existen conflictos de intereses.
Contribución de los autores
Lilibet Muñoa-Garrido: conceptualización, curación de datos, análisis formal, investigación, metodología, investigación, validación y redacción del borrador original.
Julio Michel Arias-Manganelly: curación de datos, análisis formal, investigación, metodología, redacción del borrador original.
Reinaldo Enrique Díaz-González: investigación, recursos y redacción, revisión y edición.
Financiación
Hospital General Docente “Martín Chang Puga”, Nuevitas. Camagüey, Cuba.
 Esta obra está bajo una licencia internacional Creative Commons Attribution4.0/International/Deed.
Esta obra está bajo una licencia internacional Creative Commons Attribution4.0/International/Deed.