MEDICIEGO 2015; Vol.21 No.2
ISSN: 1029-3035 / RNPS: 1821
Publicada por CPICMCAV
HOSPITAL UNIVERSITARIO
“Dr. ANTONIO LUACES IRAOLA”
CIEGO DE ÁVILA
Guía Nacional de Consenso para el Diagnóstico y Tratamiento de las Emergencias Hiperglucémicas
National Consensus Guide to the Diagnosis and Treatment of Hyperglycemic Emergencies
Volfredo José Camacho Assef (1), Armando Caballero López (2), Ileydis Iglesias Marichal (3).
| Comité de Consenso Nacional Dr. Álvarez Aldana, Dagoberto Dr. Arias Lambert, Adonis Dra. Brito García, Sonia Dr. Caballero Font, Armando David Dr. Camejo Pérez, José Aquiles Dr. Castro Alos, Marcos Dr. Chávez Díaz, David Dr. Díaz Águila, Héctor Dr. Díaz Hernández, Juan Carlos Dra. Galván Pintor, Ana Melba Dr. González Bernabé, Ángel Dr. Guerra Cruz, Guillermo Dr. Guirola de la Parra, Julio Dr. Gundián González- Piñera, José |
Dr. Gutiérrez Postigo, Yoanky Dr. Hernández San Blas, Juan Carlos DSc. Iglesias Almanza, Nuria Rosa Dra. Martínez Muñoz, Berta Dr. Montero Quesada, Néstor Dr. Moyano Alfonso, Iván Dra. Munder Fuentes, Niobis Dra. Navarro Rodríguez, Zadis Dr. Noa Arias, Ariel Dr. Pérez Parrado, Jorge Dr. Quintana Durán, Léster Armando Dr. Reinoso Fernández, Wilder Dr. Sánchez Rodríguez, Gustavo Dr. Talledo Ramos, Leandro Dr. Tejidor Bello, Duniesky Miguel |
RESUMEN
Introducción: las Guías de Consenso de mayor prestigio a nivel mundial no establecen recomendaciones específicas para el manejo del síndrome hiperglucémico (SHG) en el marco de los cuidados intensivos lo que estimula a las instituciones hospitalarias a desarrollar guías para el manejo, diagnóstico y tratamiento de este síndrome en cuidados intensivos adaptadas a los diferentes contextos regionales y/o nacionales. Objetivo: elaborar una guía de diagnóstico y tratamiento de las emergencias hiperglucémicas. Método: endocrinólogos e intensivistas en calidad de expertos, en representación de todo el país, se reunieron durante la Jornada por el 42 Aniversario de la Fundación del Centro de Atención al Diabético de La Habana, para la discusión preliminar de esta Guía Nacional. Resultados: luego de un amplio debate se estableció la versión preliminar de las guías, la cual detalla los criterios diagnósticos, objetivos, metas terapéuticas y tratamiento de los pacientes en SHG en su tránsito desde la admisión en la unidad de cuidados intensivos, hacia los cuidados intermedios y el alta hospitalaria. Se establecen las pautas de monitoreo, las insulinas aprobadas para su uso, las vías y esquemas terapéuticos en cada nivel de atención emergente, así como los criterios de transición terapéutica desde la infusión endovenosa continua de insulina hasta los esquemas de tratamiento intensivo basal-bolos indicados una vez compensado el paciente. Se establecen además las indicaciones para el manejo de los eventos hipoglucémicos y el manejo de la glucemia durante el periodo perioperatorio durante las intervenciones quirúrgicas electivas.
Palabras clave: GLUCEMIA, HIPERGLUCEMIA/terapia, CETOACIDOSIS DIABÉTICA/terapia, CONCENTRACIÓN OSMOLAR, DESEQUILIBRIO ÁCIDO-BASE/prevención y control, GUÍA DE PRÁCTICA CLÍNICA.
ABSTRACT
Introducción:consensus Guidelines most prestigious worldwide do not provide specific recommendations for the management of the Hyperglycemic syndrome under intensive care which encourages hospitals to develop guidelines for the management, diagnosis and treatment of this syndrome in intensive care adapted to different regional and / or national contexts. Objective: develop a diagnosis and treatment guide of hyperglycemic emergencies. Method: endocrinologists, and intensivists as experts representing the whole country, met during the 42nd Anniversary of the Founding of the Diabetes Care Center of Havana, for the preliminary discussion of this national guidance. Results: after extensive discussion it was established, the preliminary version of the guidelines which detail the diagnostic criteria, objectives, therapeutic goals and treatment of patients in HGS from the admission in ICU, to the intermediate care and discharge. Monitoring guidelines are established, insulins approved for use, pathways and therapeutic schemes at every level of emergent care and therapeutic transition criteria from continuous intravenous insulin infusion to the schemes of basal-bolus intensive treatment indicated once the patient was compensated. It is also established some directions for the management of hypoglycemic events and blood glucose management during the perioperative period during elective surgery.
Key words: BLOOD GLUCOSE, HYPERGLYCEMIA/therapy, DIABETIC KETOACIDOSIS/therapy, OSMOLAR CONCENTRATION, ACID-BASE IMBALANCE/prevention and control, PRACTICE GUIDELINE
SUMARIO
Características del síndrome hiperglucémico (SHG) en los pacientes críticos
Introducción
Diagnóstico
Hiperglicemia persistente
Cetoacidosis diabética (CAD)
Estado hiperosmolar hiperglucémico no cetósico (EHHNC)
Metas y objetivos terapéuticos en el síndrome hiperglucémico
Historia
Estado del arte actual de las metas y objetivos terapéuticos del síndrome hiperglucémico.
Pacientes diabéticos no hospitalizados
Metas y objetivos terapéuticos de la hiperglucemia en pacientes ingresados en salas abiertas de hospitalización
Metas y objetivos terapéuticos de la hiperglucemia en cuidados intensivos
Sumario de recomendaciones
Pacientes críticos
Pacientes no críticos
Particularidades de la Historia Clínica en el SHG agudo
Características de biodisponibilidad de las insulinas aprobadas para su uso en Cuidados Intensivos
Pautas generales del tratamiento con insulina en las emergencias hiperglucémicas
Puntos clave
Dosis y modos de administración
Comentarios
Ritmo de infusión en pacientes con deterioro de la conciencia
Manejo inicial de las emergencias hiperglucémicas
Tratamiento de la hiperglucemia persistente del paciente crítico
Factores precipitantes
Tratamiento
Medidas generales
Tratamiento con Insulina
Tratamiento de la cetoacidosis diabética
Administración de fluidos y electrolitos
Corrección de los desequilibrios acido-base y la cetosis
Tratamiento de la hiperglucemia
Comentarios
Ritmo de infusión de insulina en pacientes con deterioro de la conciencia
Restitución de las pérdidas identificadas de electrolitos
Potasio
Fosfato
Transición de la insulina de la forma intravenosa a la forma subcutánea
Tratamiento del estado hiperosmolar hiperglucémico no cetósico (EHHNC)
Administración de fluidos
Cálculo del agua corporal total ACT actual (litros)
Cálculo del agua corporal deseada.
Déficit de agua corporal (litros)
Recomendaciones para la corrección de la contracción hipernatrémica del compartimiento extracelular
Administración de insulina regular
Administración de potasio
Resolución
Diferencias y similitudes entre la cetoacidosis diabética (CAD) y el estado hiperglucémico hiperosmolar no cetósico (EHHNC) o coma hiperosmolar
Epidemiología
Patogenia
Eventos y/o factores precipitantes
Presentación y manifestaciones clínicas
Tratamiento
Algoritmo general de hidratación en la CAD y el EHHNC
Diagnóstico de las alteraciones de laboratorio clínico comunes en el SHG
Hemograma
Urea y creatinina
Uroanálisis
Glucemia
Cuerpos cetónicos
Hemoglobina glicosilada HbA1C
Sodio plasmático
Potasio
Fosfato
Estado ácido base
Anión gap
Osmolaridad
Características de los desequilibrios hidrominerales presentes en las emergencias hiperglucémicas
Criterios diagnósticos
Criterios diagnósticos
Tratamiento
Recomendaciones para la corrección de la hiponatremia
Causas
Criterios diagnósticos
Manifestaciones clínicas
Tratamiento
Esquemas terapéuticos de transición posteriores a la infusión de insulina
Puntos clave
Recomendaciones para el ajuste individual de la dosis de insulina preprandial
Escala deslizante
Protocolos de transición
Síndrome hipoglucémico
Homeostasia sistémica y contrarregulación de la glucosa
Manifestaciones clínicas
Emergencia hipoglucémica
Puntos clave
Causas y fisiopatología del síndrome hipoglucémico
Factores de riesgo
Hipoglucemia de ayuno
Fármacos hipoglucemiantes
Enfermedades graves
Deficiencias hormonales
Hipoglucemia reactiva
Síndrome hipoglucémico en Cuidados Intensivos
Diagnóstico
Antecedentes e historia clínica del episodio hipoglucémico
Examen físico
Manejo y tratamiento inicial
Glucagon
Precauciones
Criterios de alta hospitalaria
Mortalidad
Manejo perioperatorio de la glucemia
Puntos clave
Metas terapéuticas intraoperatorias
Valores de laboratorio y formularios de uso común en el diagnóstico y tratamiento de las emergencias hiperglucémicas
Sistema Internacional de Unidades
Referencias bibliográficas
CARACTERÍSTICAS DEL SÍNDROME HIPERGLUCÉMICO (SHG) EN LOS PACIENTES CRÍTICOS
Introducción
El síndrome hiperglucémico (SHG) en los pacientes en estado crítico (emergencias hiperglucémicas) comprende tres entidades bien caracterizadas desde el punto de vista clínico y de laboratorio: la hiperglucemia persistente, la cetoacidosis diabética y el estado hiperosmolar hiperglucémico no cetósico (EHHNC) o coma hiperosmolar.
Cada una de estas entidades posee criterios diagnósticos, objetivos y metas terapéuticas bien definidos y pueden presentarse de forma aislada o complicar procesos nosológicos primarios como infecciones graves, traumatismos severos, intervenciones quirúrgicas, etc.
Diagnóstico
Diagnóstico del síndrome hiperglucémico |
|||||
|
FPG |
PTG (70g)-2h |
pH |
Bicarbonato sérico |
Osmolalidad plasmática |
|
|||||
DM tipo 1 |
≥126 mg/dL (7.0 mmol/L). |
≥200mg/dL (11.1mmol/L) |
|
|
|
Cuidados intensivos |
|||||
Hiperglucemia persistente |
≥180 mg/dL (10 mmol/L) |
|
|
|
|
EHHNC |
≥600 mg/dL (33 mmol/L) |
|
>7.3 |
>18mEq/L |
≥320 mOsm/kg |
Cetoacidosis diabética |
≥250 mg/dL (13.9 mmol/L) |
|
<7.3 |
<18mEq/L |
|
EHHNC: estado hiperosmolar hiperglucémico no cetósico |
|||||
Para convertir los valores de glucemia expresados en mg/dL en mmol/L multiplicar por 0.05551. |
|||||
De acuerdo con la American Diabetes Association "Estándares de cuidados médicos en Diabetes-2010," la presencia de uno de los siguientes criterios soporta el diagnóstico de diabetes mellitus:
Hiperglicemia persistente
Esta complicación aguda del SHG también se conoce como estado hiperglucémico normo-osmolar no cetósico EHNNC (normo-osmolar nonketotic hyperglycemic state, NNHS).
El diagnóstico se establece en los pacientes en estado crítico cuando tres o más determinaciones consecutivas de la glucemia plasmática en ayuna resultan superiores a 180 mg/dL (10 mmol/L), en ausencia de acidemia (pH ≤3), y osmolalidad plasmática normal (285 mOsm/kg ±10). Este diagnóstico no implica que el paciente haya sido diagnosticado como diabético antes del ingreso hospitalario y/o continúe con esta condición con posterioridad al egreso.
Cetoacidosis diabética (CAD)
Es una situación clínica producida por un déficit absoluto o relativo de insulina, caracterizada por un trastorno metabólico consistente en tres anormalidades concurrentes: hiperglucemia, hipercetonemia y acidosis metabólica. El criterio más utilizado para el diagnóstico de la cetoacidosis diabética es la presencia de glucemia ≥250 mg/dL, pH arterial ≤7,3, bicarbonato sérico ≤18 mEq/L, y un grado moderado de cetonemia y o cetonuria.
Grados de severidad de la CAD |
||||
Severidad |
Glucemia |
pH |
Bicarbonato |
Estado de conciencia |
Ligera |
>250 mg/dL |
7.25–7.30 |
15–18 mEq/L |
Alerta |
Moderada |
>250 mg/dL |
7.00–7.24 |
10–14.9 mEq/L |
Alerta o somnolencia |
Severa |
>250 mg/dL |
<7.00 |
<10 mEq/L |
Estupor o coma |
Todos los pacientes deben presentar además niveles séricos de cetonas o hidroxibutirato positivos. |
||||
Adaptado de Sabatini S, Kurtzman NA: Bicarbonate therapy in severe metabolic acidosis. J Am Soc Nephrol 2009;20(4):692–95. |
||||
Estado hiperosmolar hiperglucémico no cetósico (EHHNC)
El EHHNC fue descrito por primera vez por Sament and Schwartz en 1957y se define por la presencia de hiperglucemia (glucosa sanguínea >600 mg/dL), hiperosmolalidad (osmolalidad sérica >350 mOsm/kg), nivel de bicarbonato sérico mayor de 15 mEq/L y pH mayor de 7,30 en ausencia de cuerpos cetónicos circulantes; todo ello asociado con depresión del sensorio o coma. Esta descripción inicial ha permanecido vigente con la sola excepción del criterio para el diagnóstico de hiperosmolalidad, que en la actualidad se acepta 320 mOsm/kg.
De acuerdo con la posición de consenso publicada por “The American Diabetes Association”, el diagnóstico del estado hiperosmolar hiperglucémico debe basarse en los siguientes criterios |
|
|
Hyperosmolar Hyperglycemic State. Robin R Hemphill. |
METAS Y OBJETIVOS TERAPÉUTICOS EN EL SÍNDROME HIPERGLUCÉMICO
Historia
El uso del tratamiento con infusión de insulina intravenosa para mejorar el pronóstico de las enfermedades críticas, comenzó en 1966 cuando Sievers J. y colaboradores, reportaron el empleo de la infusión de glucosa-potasio insulina (GPI), en el tratamiento de eventos cardiacos isquémicos. La infusión de GPI en el curso de la isquemia aguda del miocardio aumenta la captación de glucosa y su utilización, con el beneficio teórico de aumentar la eficiencia y mejorar la contractilidad del corazón durante el evento isquémico. De forma adicional, la infusión de GPI inhibe la oxidación de los ácidos grasos y disminuye la producción de substratos arritmogénicos al mejorar el consumo de oxígeno en las células del miocardio isquémico.
Furnary y colaboradores (1999), reportaron además que la infusión de insulina para el control de la hiperglucemia en el tratamiento de pacientes diabéticos disminuye la mortalidad y las infecciones de la incisión esternal en pacientes sometidos a cirugía cardíaca. Aunque sus estudios fueron criticados por el uso de controles históricos, sin duda alguna su investigación demostró, que una intervención relativamente simple como la infusión de insulina puede tener impactó positivo sobre el pronóstico en la cirugía cardiovascular.
En el año 2001, fueron publicado los estudios de Greet Van den Berghe con el título de “Tratamiento intensivo con insulina en pacientes críticos”. Esta investigadora a pesar de realizar sus estudios en una sala de cuidados intensivos post quirúrgicos (single-center), y de comparar prácticas extremas (el grupo de tratamiento convencional recibió insulina en infusión por bomba sólo si el nivel de glucosa era superior a 215 mg/dL y la velocidad de infusión se ajustó para mantener la glicemia entre 200 y 180 mg/dL mientras que el grupo sometido a tratamiento intensivo recibió insulina en infusión cuando la glicemia excedía 110 mg/dL y la velocidad de infusión se ajustó hasta mantener al paciente normoglucémico , 80 a 110 mg/dL); concluyó de forma categórica, que el tratamiento intensivo con insulina en infusión intravenosa con el propósito de mantener el nivel de la glucemia por debajo de 110 mg/dL, reduce de forma significativa (30%,) la mortalidad por todas las causas de los pacientes ingresados en cuidados intensivos, además de reducir el número de fallecidos en falla multisistémica y sepsis.
Estos resultados fueron tomados de forma entusiasta por la comunidad médica mundial, sin ser sometidos a análisis riguroso previo, y motivaron en 2004 a prestigiosas instituciones internacionales, como la Joint Commission; bajo el emblema de “Salvar muchas vidas”; a estimular programas para el control intensivo de la glucemia con el objetivo de mantener a los pacientes en las unidades de cuidados intensivos estrictamente normoglucémicos (80 a 110 mg/dL).
De igual forma la “American Diabetes Association ADA” y “The American College of Endocrinoly ACE” se sumaron a la iniciativa y propusieron márgenes para el control glucémico en los pacientes críticos estrictamente normales.
Metas para el control de la glucemia en pacientes hospitalizados 2004 |
||
Ubicación |
ADA |
ACE |
Cuidados Intensivos |
Tan cerca de 110 mg/dL como sea posible |
<110 mg/dL |
Sala General |
Mantener glucemia entre 90-110 mg/dL en ayunas <180 mg/dL postprandial |
<110 mg/dL en ayuna <180 mg/dL postprandial |
American College of Endocrinology position statement on inpatient diabetes and metabolic control. Endocrine Practice. 2004; 10(Suppl 2):4–9. |
||
En 2009, salen a la luz los primeros resultados del “Normoglycemia in Intensive Care Evaluation–Survival Using Glucose Algorithm Regulation, más conocido por sus siglas en inglés NICE-SUGAR. Este mega estudio comprendió más de 6000 pacientes médicos y quirúrgicos admitidos en las unidades de cuidados intensivos de 42 hospitales y comparó dos grupos de pacientes: un grupo control con objetivos terapéuticos convencionales (glucemia entre 180-144 mg/dL) y un grupo bajo tratamiento intensivos y objetivos terapéuticos fisiológicos (glucemia entre 81-108 mg/dL). Los resultados de esta investigación resultaron concluyentes: la probabilidad de supervivencia a los 90 días fue significativamente mayor en el grupo que recibió tratamiento convencional.
Un segundo re-análisis de los resultados del NICE-SUGAR publicado en 2012 con el título de “Hipoglucemia y riesgo de muerte en pacientes en estado crítico”, analizó la asociación entre hipoglucemia moderada (glucemia entre 41-70 mg/dL; 2.3 a 3.9 mmol/L); la hipoglucemia severa (glucemia ≤40 mg/dL, ≤2.2 mmol/L) y muerte entre los 6026 pacientes estudiados. Una vez más, los resultados fueron concluyentes:
Recientes meta-análisis que incluyen los resultados del estudio NICE-SUGAR, demuestran que el tratamiento intensivo con insulina, con el objetivo de mantener los niveles de glucemia entre 80–110 mg/dL, no resulta beneficioso e incrementa el riesgo de hipoglucemia severa. Por tal razón, en la actualidad se recomienda en los pacientes en estado crítico ingresados en unidades de cuidados intensivos el uso de insulina sólo cuando la glucosa en sangre exceda 180 mg/dL con el objetivo terapéutico de mantener niveles entre 144–180 mg/dL.
Sin duda alguna, el manejo de las concentraciones de la glucosa plasmática en cuidados intensivos, experimentó un cambio drástico en la pasada década, que aparece enunciado en las recomendaciones actuales de las organizaciones y sociedades internacionales dedicadas al control de la diabetes.
Estado del arte actual de las metas y objetivos terapéuticos del síndrome hiperglucémico
Pacientes diabéticos no hospitalizados
Se ha demostrado que la reducción de la HbA1C a cifras cercanas a 7% reduce las complicaciones microvasculares de la diabetes, si se logra poco después del diagnóstico de diabetes, este beneficio a largo plazo también reduce las complicaciones macrovasculares. Por lo tanto, una meta razonable para muchos adultos no hospitalizados, con excepción de las pacientes embarazadas, es mantener la HbA1C ≤7%.
Pueden utilizarse objetivos más estrictos de HbA1C (≤6,5%) en pacientes seleccionados (diabetes de corta duración, expectativa de vida larga, enfermedades cardiovasculares no significativas), siempre que esto se logre sin que presenten hipoglucemias significativas u otros efectos adversos del tratamiento.
Para los pacientes con antecedentes de hipoglucemia grave, esperanza de vida limitada, enfermedad microvascular avanzada; complicaciones macrovasculares, condiciones comórbidas extensas y personas con diabetes de larga duración, el objetivo de la HbA1C podría ser menos estricto (≤8%) y niveles de glucosa preprandial entre 100-150 mg/dL; ya que en ellos es difícil alcanzar el objetivo general a pesar de la educación para el autocontrol de la diabetes, el automonitoreo de la glucemia AMG y la aplicación de dosis efectivas de múltiples hipoglucemiantes, e insulina.
Metas y objetivos terapéuticos de la hiperglucemia en pacientes ingresados en salas abiertas de hospitalización
“The American Diabetes Association” (ADA 2012), recomienda en ausencia de evidencia claras para metas específicas de la glucemia en sangre en pacientes no críticos, mantener los niveles de glucosa preprandial ≤140 mg/dL (7.8 mmol/L) y niveles de glucemia postprandial ≤180 mg/dL (10.0 mmol/L).
Las metas terapéuticas deben ser menos exigentes en pacientes con comorbilidades severas y más rigurosas en pacientes estables, que se adhieran con responsabilidad al tratamiento.
Metas y objetivos terapéuticos de la hiperglucemia en cuidados intensivos
En el último quinquenio se ha producido un viraje considerable en los objetivos y metas del tratamiento de los estados hiperglucémicos en cuidados intensivos avalado por un creciente número de evidencias que demuestran efectos devastadores de la hipoglucemia en los enfermos y aumento significativo de la mortalidad.
“The American Diabetes Association” ADA y American Association of Clinical Endocrinologists (AACE) recomiendan iniciar la terapia insulínica en presencia de hiperglucemia persistente >180 mg/dL (10 mmol/L) y mantener los niveles de insulina plasmática en un rango de 140–180 mg/dL (7.8 to 10 mmol/L) en la mayoría de los pacientes críticos.
The American College of Physicians (ACP) recomiendan mantener el nivel de glucemia entre 140-200 mg/dL en pacientes diabéticos en unidades de cuidados intensivos no quirúrgicas. Estas guías responden a la revisión de 21 investigaciones realizadas en pacientes diabéticos ingresados en cuidados intensivos, cuidados perioperatorios y unidades de cuidados intensivos cardiovasculares y cerebrovasculares. Se enfatiza además, que objetivos más rigurosos, en un rango de 110–140 mg/dL (6.1–7.8 mmol/L) de glucemia; pueden ser apropiados en pacientes seleccionados, siempre y cuando se alcancen sin hipoglucemia significativa. Sin embargo en ciertas circunstancias tales como cirugía cardiovascular o unidades de cuidados intensivos postquirúrgicos, resulta se suma importancia mantener un nivel de glucemia muy próximo a la normalidad, este tipo particular de paciente debe recibir suficiente insulina para mantener los niveles de glucemia cercanos a la normalidad (100 mg/dL).
La Sociedad de Cirugia Torácica “The Society of Thoracic Surgeons” recomienda para el control intraoperatorio de pacientes sometidos a cirugía cardíaca, iniciar el tratamiento con insulina cuando los niveles de glucemia alcances cifras >180 mg/dL y continuar el tratamiento con insulina en el postoeperatorio, recomendando mantener la glucemia ≤150 mg/dL en aquellos pacientes que permanecen por más de tres días en la unidad de cuidados intensivos.
Durante los días 28-29 de Mayo de 2014, endocrinólogos, investigadores e intensivistas en representación de todo nuestro país se reunieron durante el “Primer Taller Nacional de Consenso sobre Urgencias en Diabetes” se estableció considerar como umbral para iniciar la terapéutica con infusión intravenosa con insulina en los pacientes en estado crítico la cifra de 180 mg/dL y considerar una meta razonable mantener los niveles de glucemia entre 140-180 mg/dL a lo largo de todo el ingreso.
Recomendaciones para las metas del control de la glucemia en pacientes críticos |
|
Organización |
Recomendación |
Sociedad de Cirugía Torácica “Society of Thoracic Surgeons” |
Mantener el nivel de glucemia en sangre <180 mg/dL. Si el paciente permanece en UCI por más de 3 días mantener la glucemia <150 mg/dL. |
Asociación Americana de Endocrinólogos Clínicos y Asociación Americana de Diabetes “American Association of Clinical Endocri-nologists (AACE) y American Diabetes Association (ADA)” |
Mantener el nivel de glucemia entre 140 - 180 mg/dL |
Colegio Médico Americano “American College of Physicians” |
Mantener el nivel de glucemia entre 140-200 mg/dL en pacientes diabéticos en unidades de cuidados intensivos no quirúrgicas. Objetivos más rigurosos, 110–140 mg/dL (6.1–7.8 mmol/L) pueden ser apropiados en pacientes seleccionados, siempre y cuando se alcancen sin hipoglucemia significativa. En cirugía cardiovascular o unidades de cuidados intensivos postquirúrgicos mantener el nivel de glucemia muy próximo a la normalidad (100 mg/dL). |
Sociedad Médica de Cuidados Críticos “Society Critical Care Medicine” |
≤150 mg/dL |
Primer Taller Nacional de Consenso sobre Urgencias en Diabetes 2014 |
Mantener el nivel de glucemia entre 140 - 180 mg/dL |
Sumario de recomendaciones
Pacientes críticos
Pacientes no críticos
PARTICULARIDADES DE LA HISTORIA CLÍNICA EN EL SHG AGUDO
La historia cínica de un paciente diabético, debe recoger de forma explicitas los antecedentes, la historia natural de la enfermedad, los síntomas y signos que justifiquen complicaciones agudas, la adherencia del paciente al tratamiento y el seguimiento y control recibido por el paciente previo a la ingreso. Resulta de suma importancia, para poder realizar la transición del tratamiento con insulina en infusión endovenosa a los diferentes esquemas de insulina basal-bolos (deslizantes), precisar los requerimientos de insulina e hipoglucemiantes orales del paciente previo al ingreso y las características y dosificación de los esquemas terapéuticos recibidos con anterioridad al ingreso.
Antecedentes y sintomatología a precisar:
En el examen físico deben destacarse además lo siguientes elementos:
Si el paciente es un diabético conocido, establecer:
Características de biodisponibilidad de las insulinas aprobadas para su uso en Cuidados Intensivos
Las diferentes guías de consenso internacional, para el manejo del SHG, recomiendan sin excepción, la suspensión de los hipoglucemiantes orales en pacientes previamente tratados con estos medicamentos mientras se mantenga el estado crítico de los pacientes ingresados en unidades de cuidados intensivos.
De forma general, se contraindica el uso de insulina por vía subcutánea o intramuscular, dada las irregularidades de absorción de esta vía en pacientes con inestabilidad hemodinámica e hipoperfusión tisular.
La administración de insulina regular en bolus intravenosa, propuesta en los diferentes esquemas terapéuticos deslizantes, resulta menos fisiológica y en teoría, aumenta la liberación de hormonas contra reguladoras. En tal sentido; la infusión continua de insulina por vía intravenosa disuelta en solución salina, resulta el método más eficaz y preferido por los intensivitas en nuestro país, debido a que produce disminución de los niveles de glucemia de forma efectiva, gradual y sostenida.
En Junio del 2000, salen al mercado los primeros dos análogos de la insulina de acción ultrarrápida, aprobados para su uso en todo paciente crítico incluyendo a las mujeres embarazadas. En este contexto, los análogos de acción ultrarrápida lispro y aspart reciben la categoría B para su uso durante el embarazo, lo cual significa que los estudios clínicos, no han presentado aumento de riesgo para el feto.
Los análogos de insulina de acción prolongada, forman microprecipitados en el tejido graso, a partir de los cuales pequeñas cantidades de insulina se liberan gradualmente sin producir picos plasmáticos, por tal razón, su liberación tisular se realiza a un ritmo constante por más de 24 horas. Los análogos de acción prolongada, no están recomendados en el tratamiento de la urgencia hiperglucémica en los pacientes críticos. En esta situación, se recomienda el uso de análogos de insulina de acción ultrarrápida o insulina regular.
En estudios aleatorios controlados realizados durante el embarazo, la insulina detemir reduce la HbA1C de forma similar a la NPH sin presentar diferencias en relación al feto y el recién nacido.
Características de biodisponibilidad de las insulinas aprobadas para su uso en Cuidados Intensivos |
||||
Preparación |
Inicio |
Pico (h) |
Duración (h) |
Categoría en el embarazo |
Ultrarrápidas (análogos) |
||||
Lispro |
5-15 min |
0.5-1.5 |
3-4 |
B |
Aspart |
5-15 min |
0.5-1.5 |
3-4 |
B |
Glusine |
5-15 min |
0.5-1.5 |
3-4 |
C |
Acción rápida (humana) |
||||
Regular |
30-60 min |
2 |
6-8 |
B |
Acción Intermedia (humana) |
||||
Humana NPH |
2-4 h |
6-7 |
10-20 |
B |
Acción prologada (análogos) |
||||
Glargine |
1.5 h |
basal |
24 |
C |
Detemir |
1-2 h |
basal |
17 |
B |
Categoría B: no existen evidencias de riesgo en la especie humana. Los estudios en animales no han demostrado un efecto adverso sobre el feto, pero no hay estudios clínicos adecuados y bien controlados hechos en mujeres embarazadas. Los estudios de reproducción en animales han demostrado efectos adversos diferentes a una disminución en la fertilidad. Categoría C: estudios en reproducción animal han mostrado un efecto adverso sobre el feto o no se ha podido demostrar su inocuidad. No hay estudios adecuados y bien controlados en humanos, sin embargo los beneficios potenciales permiten utilizar el fármaco en mujeres embarazadas a pesar de sus riesgos potenciales. |
||||
Pautas generales del tratamiento con insulina en las emergencias hiperglucémicas
Puntos clave
Dosis y modos de administración
La terapia con insulina regular (cristalina o actrapid) se inicia con un bolo intravenoso de 0,15 U/Kg o 10 U de insulina corriente, seguido por una infusión intravenosa de insulina a un ritmo de 0,1 U/kg/h. (5 a 10 U/hora en adultos). De forma paradójica, como la sensibilidad a la insulina disminuye con la edad, los ancianos tienden a requerir más insulina durante el manejo agudo de la hiperglucemia.
Se debe establecer el valor de glucosa en sangre en forma horaria. Si la glucosa no disminuye al menos 50 mg/dL en la primera hora se debe duplicar la dosis de insulina en forma horaria hasta que se verifique el descenso a un ritmo horario de 50 a 70 mg/dL. Los pacientes con cetoacidosis rara vez tienen resistencia insulínica. La incapacidad para responder a dosis de 5 a 7 U/hora debe sugerir infección asociada o persistencia del estado de deshidratación e hipovolemia.
Durante el tratamiento de la CAD (siempre que la acidosis persista); debe disminuirse la infusión de insulina a 0.05 U/kg/h cuando la glucosa en sangre alcance valores ≤250 mg/dL (13.8 mmol/L) e iniciar la administración de dextrosa al 10% a razón de 125 ml/h.
Comentarios
Como ya se ha descrito, el propósito principal de la terapéutica con insulina no es disminuir los niveles de glucosa sino corregir la acidosis. Por lo tanto, los pacientes deben recibir insulina intravenosa hasta que la brecha aniónica (el anión gap) sea normal. Esto puede requerir la adición de glucosa a los fluidos de hidratación, o disminuir levemente la infusión de insulina, a fin de que no se produzca hipoglucemia. Puesto que en estas circunstancias la utilización de glucosa es de 5 a 10 g/hora, se debe administrar a esta concentración para evitar los descensos. Si con ello la concentración de glucosa tiende a aumentar, conviene reducir la administración; si por el contrario continúa disminuyendo, es que se requiere una cantidad adicional de la misma.
En presencia de insulina y adecuada hidratación, la concentración plasmática de glucosa habitualmente disminuye a una velocidad de 75 a 100 mg/dL/hora, y alcanza una concentración de 250-300 mg/dL en seis horas. El bicarbonato plasmático y el pH aumentan más lentamente, y alcanzan valores de 15 a 18 mEq/l y 7,30, respectivamente, en aproximadamente 8 a 12 horas.
Ritmo de infusión en pacientes con deterioro de la conciencia
En general, se estima que un paciente con deterioro de conciencia por cetoacidosis diabética con elevada osmolaridad, requiere el mismo número de horas para aclarar el sensorio que las que necesita para la normalización de la concentración de bicarbonato o el pH sérico. En estos pacientes, se aconseja no disminuir bruscamente los niveles de glucosa, y mantener un nivel de alrededor de 300 mg/dL con la infusión de soluciones de glucosa e insulina, hasta que el paciente esté alerta y orientado.
MANEJO INICIAL DE LAS EMERGENCIAS HIPERGLUCÉMICAS
Cualquiera sea la forma clínica de la emergencia del SHG, existen pautas generales para la recepción, reanimación y soporte vital y monitoreo de todo paciente crítico que ingresa en una unidad de cuidados intensivos.
Estas medidas generales comprenden:
Junto con las medidas iniciales de recepción, monitoreo y manejo del paciente debe establecer una rutina de seguimiento de análisis de laboratorio que comprenda la realización inmediata y periódica de las siguientes investigaciones: glucosa sérica, cuerpos cetónicos, ionograma, gasometría arterial, urea y creatinina, hematocrito, hemoglobina, recuento de glóbulos blancos, estudio de coagulación, hemocultivo y urocultivo, osmolalidad sérica, lactato y piruvato en sangre, amilasa sérica y urinaria. Se deberán obtener, además, radiografía de tórax y electrocardiograma al ingreso.
TRATAMIENTO DE LA HIPERGLUCEMIA PERSISTENTE DEL PACIENTE CRÍTICO
Esta complicación aguda del SHG también se conoce como como estado hiperglucémico normo osmolar no cetósico EHNN.
El diagnóstico de hiperglucemia persistente (no cetoacidótica y no hiperosmolar), se establece de inmediato cuando en un paciente es estado crítico, tres o más determinaciones seriadas de la glucemia plasmática se encuentran por encima de 180 mg/dL, en ausencia de hiperosmolaridad plasmática y acidosis metabólica secundaria al aumento de los cuerpos cetónicos.
En necesario, antes de comenzar el tratamiento con insulina regular en infusión continua, establecer el diagnóstico diferencial con los eventos hiperglucémicos eventuales presentes con frecuencia en los pacientes en estado crítico (sin que en ocasiones se recojan antecedentes personales de diabetes). La causa de estos eventos guarda relación con la medicación recibida por el paciente, la respuesta del organismo al estrés y la liberación de hormonas contrarreguladoras. En tratamiento consiste en la hidratación generosa del paciente y la administración de insulina regular en bolos intravenosa a razón de 1 unidad por cada 50 mg/dL, de incremento de la glucemia por encima del umbral crítico aceptado en cuidados intensivos (180 mg/dL).
Factores precipitantes
En ámbito de los cuidados intensivos, la hiperglucemia persistente puede ser la forma de presentación de la diabetes y se presenta muchas veces asociada a enfermedades en curso como el infarto del miocardio, pancreatitis, abdomen agudo e hipertiroidismo.
Otras veces la hiperglucemia persistente forma parte de la emergencia, cuando esta ha sido diagnosticada y tratada oportunamente y no se ha establecido los estados de deshidratación, la hiperosmolaridad y la cetoacidosis metabólica característicos de las formas clínicas más graves del síndrome.
Algunos pacientes sin antecedentes de diabetes, pueden presentar hiperglucemia asociado a la gravedad, en los mismos, la respuesta general del organismo al stress (médico, quirúrgico o emocional), la liberación de hormonas contrarreguladoras, y medicamentos de uso común en cuidados intensivos como los esteroides, diuréticos, medicamentos beta agonistas, y drogas antipsicóticas pueden tener relación causal con el estado hiperglucémico.
Los eventos hiperglucémicos pueden ser transitorios o permanentes necesitando tratamiento continuo una vez egresado el paciente. En otras situaciones, el paciente desarrolla una de las formas clínicas de la diabetes mellitus poco tiempo o años después de su egreso, por tal motivo, los antecedentes de eventos hiperglucémicos asociados a ingresos hospitalarios debe ser tenida muy en cuenta en la historia clínica del paciente.
Tratamiento
El tratamiento de los estados hiperglucémicos normo osmolares no cetósicos, va dirigido fundamentalmente al control de la hiperglucemia y a la prevención de la deshidratación, la hiperosmolaridad y la cetoacidosis.
El objetivo terapéutico de esta entidad no difiere de las formas más graves del síndrome, resultado adecuado mantener la glucemia en un rango entre 140-180 mg/dL, en otras palabras, existe consenso en aceptar la hiperglucemia moderada por encima del riesgo de hipoglucemia severa, en todo paciente crítico.
Tan importante como tratar la hiperglucemia, resulta diagnosticar a tiempo las complicaciones metabólicas de la entidad, por tal razón los pacientes deben ser sometidos a un monitoreo intensivo de los parámetros vitales y a un control de las variables metabólicas de igual intensidad al indicado en las formas más graves del SHG.
Medidas generales
Tratamiento con Insulina
Todo los evento hiperglucémico persistente diagnosticado en la unidad de cuidado intensivo, debe ser tratado de inmediato con insulina regular en infusión continua, cuando la glucemia plasmática rebasa en tres o más determinaciones el valor umbral de 180 mg/dL.
Si el paciente se encuentra deshidratado, la insulina sólo está indicada cuando se haya iniciado con éxito la reposición de volumen.
Como regla general, la insulina regular se administra en forma de un bolo intravenoso inicial de 0,1 a 0,2 U de insulina regular por kilogramo de peso, seguido de la infusión constante de 0,1 U/kg por hora. Utilizando este régimen, los niveles de azúcar en sangre descienden aproximadamente 80-100 mg/dL por hora. Si la glucemia no desciende como se desea o incluso si aumenta, la dosis de insulina debe ser duplicada a intervalos de dos horas.
TRATAMIENTO DE LA CETOACIDOSIS DIABÉTICA
El manejo de la cetoacidosis diabética, al menos durante las primeras 48 horas, siempre debe realizarse en la unidad de cuidados intensivos. Durante el inicio del tratamiento, se aconseja respetar los siguientes principios terapéuticos:
Los objetivos del tratamiento específico en orden de prioridad estarán dirigidos a:
Administración de fluidos y electrolitos
La deshidratación puede definirse como un estado clínico de deficiencia de agua, en el cual se ha perdido un 4 a 8% o más del peso corporal en forma de líquido. El déficit de fluidos en un paciente en cetoacidosis diabética es de 100 ml/kg como promedio, lo cual representa en los pacientes adultos pérdidas superiores a 7 litros cuando ingresa en el servicio de emergencia.
El flujo urinario relativamente alto secundario a la glucosuria produce la falsa impresión de que el paciente recibe un aporte hídrico adecuado, cuando en realidad se está estableciendo una contracción progresiva del volumen de agua corporal total.
El desarrollo de deshidratación y depleción de sodio en los estados hiperglucémicos es el resultado del aumento del volumen urinario y de la pérdida de electrolitos. La hiperglucemia produce diuresis osmótica en la cetoacidosis diabética. La excreción de cetoaniones, que obliga a la excreción de cationes urinarios tales como sodio, potasio y sales de amonio, también contribuye a la diuresis de solutos. Otro factor a tener en cuenta, es el aumento de las perdidas respiratorias insensibles de líquido, secundarias al aumento de la frecuencia respiratoria (poliapnea compensatoria) presente en toda acidosis metabólica.
Una valoración aproximada del balance negativo de agua de un paciente hipernatrémico, suponiendo que la pérdida de agua no ha sido acompañada por una pérdida de sodio concomitante, se obtiene con la siguiente fórmula:
Déficit de agua libre = 0,6 x peso corporal (kg) x [(sodio plasmático/140) - 1]
Como regla general, la mitad de las pérdidas deben reemplazarse en las primeras 12 horas y el resto en un período de 24 a 36 horas. Las pérdidas concomitantes, insensibles y renales, que ocurren durante el período de rehidratación, también deben ser reemplazadas.
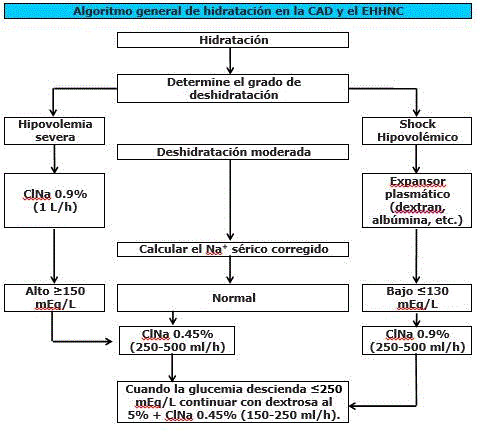
Existen numerosos esquemas terapéuticos para la reposición de volumen, la mayor parte de los cuales, recomiendan como regla general, iniciar el tratamiento con solución salina isotónica al 0.9%, a razón de 15 a 20 ml/kg durante la primera hora. Una excepción, se presenta en pacientes con hipotensión arterial o shock, en los cuales la reanimación con volumen debe iniciarse con la administración rápida de un expansor plasmático, como dextrán-40 o albúmina humana.
El uso de solución salina isotónica o hipotónica en el tratamiento de la cetoacidosis diabética continua controvertido, no obstante prevalece la opinión uniforme de que el primer litro de solución de hidratación debe ser solución salina normal al 0,9%; administrada tan pronto como sea posible dentro de la primera hora, seguido de 500-1.000 ml/h de solución al 0,45 o 0,9%, dependiendo del valor de sodio sérico corregido, durante la próximas dos horas. A partir de allí se continuará con un ritmo de 4 a 14 ml/kg/hora, dependiendo del estado de hidratación. El los pacientes adultos jóvenes el déficit de fluido debe corregirse en las primeras 24 horas.
Esquema general de re-hidratación en la CAD |
|
1 hora |
1 L solución salina S 0.9% |
Segunda y tercera horas |
500-1.000 ml/h de solución al 0,45 o 0,9%, dependiendo del valor de sodio sérico |
Resto de las 24 horas |
4 a 14 ml/kg/hora; en dependencia del estatus hemodinámico. |
El volumen total de reposición en las primeras 4 horas no debe exceder 40-50 mL/kg. |
|
La contracción del espacio extracelular secundaria a la glucosuria osmótica presente en la CAD, generalmente se acompaña de hiponatremia. Esto es consecuencia de que la concentración sérica de sodio tiende a aumentar por la diuresis osmótica producida por la glucosuria y tiende a caer por el movimiento de agua desde el espacio intracelular hacia el espacio extracelular inducido por la hiperglucemia (hiponatremia dilucional). Los tipos específicos de desequilibrio hidromineral presente en las emergencias hiperglucémicas, los criterios para el diagnóstico y las recomendaciones para su manejo terapéutico, aparecen detallados en el capítulo “Consideraciones sobre los tipos de desequilibrio hidromineral presentes en el SHG”.
Los pacientes en insuficiencia cardíaca congestiva, insuficiencia renal u otras comorbilidades críticas, requieren de modificaciones de la fluidoterapia estándar, la cual debe basarse en la estimación cuidadosa de los signos vitales y las variables hemodinámica (tensión arterial, presión venosa central y/o pulmonar en cuña, diuresis horaria, perfusión tisular, etc.).
El reemplazo de fluidos en la cetoacidosis diabética debe ser guiado por los mismos principios que son aplicables en otros estados de depleción de volumen, incluyendo la estimación del déficit inicial, las necesidades de mantenimiento y las pérdidas concomitantes de fluidos durante el reemplazo. Cualquiera que sea el esquema de rehidratación empleado, el volumen de remplazo debe modificarse en función del estatus hemodinámico (frecuencia cardíaca, tensión arterial y presión venosa central), el gasto urinario (que debe ser al menos de 30 a 60 ml/h), la concentración de electrolitos séricos y el estatus mental.
Habitualmente, los pacientes requieren la infusión de 6 a 10 litros de fluidos en las primeras 24 horas, siendo la meta de la rehidratación la reducción de la osmolalidad sérica efectiva en un rango no superior a 3 mOsm/h. Los pacientes con buena tolerancia oral, pueden recibir por esta vía parte del volumen líquido a reemplazar
Otro de los esquemas de hidratación más conocidos; aceptados para la reposición de volumen en unidades donde resulta imposible la monitorización hemodinámica de forma adecuada, utiliza solución salina isotónica como sigue:
Si persiste la hipernatremia, cuando el paciente alcanza el estado de euvolemia, puede infundirse solución salina hipotónica al 0.45%.
Corrección de los desequilibrios acido-base y la cetosis
La cetoacidosis resulta de la desviación del metabolismo desde la oxidación de la glucosa a la de los ácidos grasos. Esto ocurre cuando la glucosa no está disponible como fuente energética, pudiendo ser el resultado de una falta absoluta de la misma, como en el ayuno, o de una incapacidad de acceder a la célula, como en la carencia de insulina. En este último caso, los ácidos grasos son movilizados como fuentes de energía. La cetoacidosis se produce en los diabéticos sólo si la deficiencia de insulina es casi completa, y existe un exceso de glucagón.
El cálculo del anión gap (Anión gap = Na+- (Cl- + CO3H-) Valor normal: 12±4 permite separar a las causas de acidosis metabólica en dos tipos mayores. El primer tipo se caracteriza por un anión gap normal (acidosis con anión gap normal o acidosis metabólica hiperclorémica), mientras que el segundo tipo muestra un anión gap elevado (acidosis con anión gap elevado o acidosis metabólica normoclorémica). Utilizando los datos del balance ácido base y del anión gap, Adrogué y colaboradores comprobaron que el 46% de los pacientes con cetoacidosis diabética tienen una acidosis con anión gap aumentado, 43% tienen acidosis mixta, y 11% tienen acidosis hiperclorémica al ingreso.
Dos mecanismos fundamentales explican el desarrollo de la acidosis metabólica con anión gap elevado del paciente diabético: primero, el aporte de una carga excesiva de ácidos no HCl, endógenos (cuerpos cetónicos), que superan la capacidad normal del organismo de procesarlos y excretarlos. Segundo, una disminuida capacidad del riñón para excretar la carga normal de ácidos fijos endógenos, la que es responsable de la acidosis urémica.
Adrogué y colaboradores han establecido que el aumento del anión gap sólo se desarrolla en pacientes en los que la depleción de volumen impide que los cuerpos cetónicos sean eliminados por la orina.
Efectos sistémicos de la cetoacidosis diabética CAD |
Cardiovasculares |
Disminución de la función contráctil cardíaca |
Disminución del flujo renal y hepático |
Disminución del umbral de fibrilación ventricular |
Disminución de la sensibilidad cardíaca a las catecolaminas |
Taquicardia y arritmias. Riesgo de fibrilación ventricular |
Neurológicos |
Obnubilación y coma |
Aumento del flujo sanguíneo cerebral |
Aumento de la descarga simpática |
Disminución de la respuesta a las catecolaminas circulantes |
Disminución del metabolismo cerebral |
Respiratorios |
Aumento de la ventilación minuto |
Disnea |
Fatiga de los músculos respiratorios |
Metabólicos |
Hiperpotasemia, hiperfosfatemia y aumento del calcio iónico |
Aumento del catabolismo proteico |
Resistencia a la insulina |
La experiencia acumulada favorece la administración de bicarbonato de sodio como agente buffer en el tratamiento de la acidosis metabólica. El beneficio potencial de su empleo reside en la mejoría de los efectos de la acidosis sobre el aparato cardiovascular. La acidosis severa puede determinar disminución de la contractilidad cardíaca con disminución del volumen minuto cardíaco, vasodilatación e hipotensión, disminución del flujo sanguíneo hepático y renal, bradicardia y aumento de la susceptibilidad a las arritmias. Estos efectos adversos generalmente aparecen cuando el pH disminuye por debajo de 7,10. Los oponentes del tratamiento con bicarbonato argumentan el efecto paradójico sobre el líquido cefalorraquídeo de la acidosis y la desviación a la izquierda de la curva de oxihemoglobina, que resulta en hipoxia tisular.
El bicarbonato de sodio está indicado cuando la acidosis ofrece peligro inmediato para la vida, especialmente cuando se asocia a sepsis o acidosis láctica o cuando la acidosis presenta efectos deletéreos sobre la hemodinamia cardíaca.
En el criterio prevalente, sólo se deberá tratar la acidosis cuando el pH sea menor de 7,10 o cuando después del tratamiento etiológico adecuado persistan signos o síntomas imputables a la acidosis. En estos casos se utiliza como sustancia buffer el bicarbonato de sodio. Como el déficit de base que se pretende corregir es el del espacio extracelular (que constituye la tercera parte del peso corporal), basta multiplicar ese déficit por litro por el volumen del líquido extracelular para obtener el valor de bicarbonato que debe utilizarse:
Cantidad de bicarbonato en mEq = exceso de base x 0,3 x peso en Kg
Esta cantidad se administra en forma fraccionada en infusión, nunca en bolos intravenosos, intentando una corrección parcial del trastorno. Luego de esa corrección, se evaluará nuevamente el estado ácido base. Las soluciones disponibles en nuestro país útiles para emplear son bicarbonato de sodio 4% x 10 ml x amp y bicarbonato de sodio 8% x 10 ml x amp.
Kitabchi recomienda no utilizar bicarbonato si el pH es mayor de 7,0. Para rangos de pH entre 6,9 y 7,0, recomienda administrar 44 mEq de bicarbonato de sodio, y cuando el pH es menor de 6,9, 88 mEq de bicarbonato. Debido a la hiperosmolaridad de la solución, aconseja que el bicarbonato se administre diluido (100 mEq en 400 mL de H2O a 200 ml/hora).
Tratamiento de la hiperglucemia
La terapia con insulina regular (cristalina o actrapid) se inicia con un bolo intravenoso de 0,15 U/Kg o 10 U de insulina corriente, seguido por una infusión intravenosa de insulina a un ritmo de 0,1 U/kg/h. (5 a 10 U/hora en adultos). De forma paradójica, como la sensibilidad a la insulina disminuye con la edad, los ancianos tienden a requerir más insulina durante el manejo agudo de la hiperglucemia.
Se debe establecer el valor de glucosa en sangre en forma horaria. Si la glucosa no disminuye al menos 50 mg/dL en la primera hora se debe duplicar la dosis de insulina en forma horaria hasta que se verifique el descenso a un ritmo horario de 50 a 70 mg/dL. Los pacientes con cetoacidosis rara vez tienen resistencia insulínica. La incapacidad para responder a dosis de 5 a 7 U/hora debe sugerir infección asociada o persistencia del estado de deshidratación e hipovolemia.
Durante el tratamiento de la CAD (siempre que la acidosis persista); debe disminuirse la infusión de insulina a 0.05 U/kg/h cuando la glucosa en sangre alcance valores ≤250 mg/dL (13.8 mmol/L) e iniciar la administración de dextrosa al 10% a razón de 125 ml/h.
Comentarios
El objetivo primario de la terapéutica con insulina es revertir la cetogénesis, suprimir la lipolisis, e inhibir la gluconeogénesis hepática. La insulina también disminuye la osmolaridad plasmática efectiva aumentando la permeabilidad celular a la glucosa. Se deben tener varias precauciones, sin embargo, al iniciar la terapéutica con insulina. La terapéutica con insulina no se debe iniciar en pacientes con hipotensión y severa hiperglucemia hasta no haber logrado la resucitación volumétrica efectiva. La insulina aumenta el transporte intracelular de glucosa y aumenta el traspaso de líquidos desde el espacio extracelular al intracelular. Bajo estas condiciones, con la aplicación de insulina, pueden pasar de dos a tres litros de líquido hacia el compartimento intracelular, profundizando el shock hipovolémico y aumentando el riesgo de tromboembolismo en presencia de una resucitación volumétrica inadecuada.
Debido a que la insulina media la reentrada de potasio hacia el compartimento intracelular, la misma puede producir hipopotasemia grave y debe ser evitada en los pacientes que presentan concentraciones de potasio sérico inferiores a 3,3 mEq/L en el momento de ingreso. La administración de insulina en estos casos puede producir arritmias, deterioro de la función cardiovascular, debilidad muscular e insuficiencia ventilatoria. Constituye por tanto, requisitos obligados para el inicio del tratamiento con insulina, la reposición previa, adecuada y efectiva de volumen y potasio.
Cuando la concentración de glucosa en sangre disminuye por debajo de 250 mg/dL, se debe adjuntar dextrosa a la solución de fluido de reemplazo. Esto se realiza con una solución de dextrosa al 5% en la mayoría de los casos.
Ello permite la administración continua de insulina hasta que se alcance el control total de hiperglucemia y se normalice la osmolaridad plasmática, evitando de esta forma el desarrollo de edema cerebral, complicación que se presenta con frecuencia en los niños.
El propósito principal de la terapéutica con insulina no es disminuir los niveles de glucosa sino corregir la acidosis. Por lo tanto, los pacientes deben seguir recibiendo insulina intravenosa hasta que hayan normalizado el anión gap. Esto puede requerir la adición de glucosa a los fluidos de hidratación, o disminuir levemente la infusión de insulina, a fin de que no se produzca hipoglucemia. Puesto que en estas circunstancias la utilización de glucosa es de 5 a 10 g/hora, se debe administrar glucosa intravenosa a esta concentración para evitar el descenso brusco de la glucemia sin que se haya producido la corrección de la acidosis. Si con ello la concentración de glucosa tiende a aumentar, conviene reducir la administración; si por el contrario continúa disminuyendo, es que se requiere una cantidad adicional de la misma.
El error que más frecuentemente se comete en el tratamiento de la cetoacidosis diabética es la supresión prematura de la insulina cuando los niveles de glucosa disminuyen a 200-250 mg/dL. Como ya se ha descrito, el propósito principal de la terapéutica con insulina no es disminuir los niveles de glucosa sino corregir la acidosis.
En presencia de insulina y adecuada hidratación, la concentración plasmática de glucosa habitualmente disminuye a una velocidad de 75 a 100 mg/dL/hora, y alcanza una concentración de 250-300 mg/dL en las primeras seis horas de tratamiento. El bicarbonato plasmático y el pH aumentan más lentamente, y alcanzan valores de 15 a 18 mEq/L y 7,30, respectivamente, en aproximadamente 8 a 12 horas.
Ritmo de infusión de insulina en pacientes con deterioro de la conciencia
En general, se estima que un paciente con deterioro de conciencia por cetoacidosis diabética con elevada osmolaridad, requiere el mismo número de horas para aclarar el sensorio que las que necesita para la normalización de la concentración de bicarbonato o el pH sérico. En estos pacientes, se aconseja no disminuir bruscamente los niveles de glucosa, y mantener un nivel de alrededor de 300 mg/dL con la infusión de soluciones de glucosa e insulina, hasta que el paciente esté alerta y orientado.
Restitución de las pérdidas identificadas de electrolitos
La diuresis osmótica propia de la CAD y el estado hiperosmolar hiperglucémico y la excreción de cetoaniones característica de la CAD, promueven la pérdida neta de múltiples minerales y electrolitos (Na, K, Ca, Mg, Cl, y PO4), algunos de los cuales pueden ser reemplazados de inmediato y otros requieren días o semanas para restauración adecuada y balance.
Potasio: la pérdida excesiva de potasio con la orina es responsable del desarrollo de depleción de potasio. La pérdida urinaria de potasio se produce como consecuencia de la diuresis osmótica que conduce a un aumento de la oferta de fluidos y de sodio a los sitios secretores de potasio en la nefrona distal.
El hiperaldosteronismo secundario consecuente a la depleción de sodio y la presencia de cetoaniones cargados negativamente en el fluido tubular aumentan aún más las pérdidas de potasio.
Los pacientes en cetoacidosis diabética suelen presentarse inicialmente con aumento de los niveles de potasio sérico asociado a acidosis metabólica, pero con marcado déficit del potasio total del organismo. Por tal razón, cuando se inicia la reposición de la volemia y la administración de insulina, se produce una disminución brusca y severa de las cifras de potasio sérico inicial.
El potasio es con mucho el electrolito principal que debe ser manejado durante las emergencias del diabético.
En la CAD, el déficit total de potasio oscila entre 3 to 5 mEq/kg de peso corporal, pudiendo llegar a 10 mEq/kg, en los casos más severos.
Durante el tratamiento de la cetoacidosis diabética se debe realizar el monitoreo horario de los niveles de potasio sérico. Resultan además, de suma utilidad el monitoreo electrocardiográfico y la respuesta de los reflejos tendinosos.
De existir hiperpotasemia al ingreso, la infusión precoz de potasio debe diferirse.
Indicaciones para la infusión precoz de potasio:
Smawics sostiene que el diagnóstico electrocardiográfico de hipopotasemia basado en los trastornos de la repolarización ventricular debe establecerse con los siguientes hallazgos:
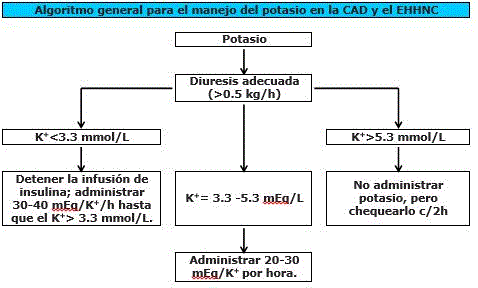
La administración de potasio IV debe comenzar tan pronto como se restablezca la diuresis y el potasio sérico disminuya por debajo de 5.5 mEq/L.
Esquema terapéutico para la administración de potasio suplementario en la CAD |
|
Concentración sérica |
Tratamiento |
Más de 5.5 mEq/L |
No administrar potasio suplementario. |
Entre 4.5 y 5.5 mEq/L |
Administrar 10 mEq/h por hora. |
Entre 4 y 4.5 mEq/L |
Administrar 20 mEq de potasio por hora. |
Entre 3 y 4 mEq/L |
Infundir 40 mEq por hora en las primeras dos horas y luego 20 mEq por hora. |
Entre 2.5 y 3 mEq/L |
Infundir 40 mEq por hora. |
Menos de 2.5 mEq/L |
Administrar 60 mEq por hora. |
Una práctica aconsejada es reponer 2/3 del potasio en forma de cloruro de potasio KCl, y un 1/3 en forma de fosfato de potasio K2PO4. |
|
Debido al riesgo asociado de producir hipopotasemia severa al penetrar la glucosa junto con el potasio a la célula, está contraindicada la administración de insulina hasta que el nivel de potasio sérico sea superior a 3.3 mEq/L.
Fosfato: en pacientes con cetoacidosis diabética, el comienzo de la hipofosfatemia es habitualmente temprano, aparece en las primeras 24 horas y alcanza su máximo entre las 24 y 36 horas. Los pacientes diabéticos que desarrollan glucosuria, cetonuria y poliuria pierden excesiva cantidad de fosfato con la orina. La acidosis metabólica, por su parte, aumenta la pérdida urinaria de fosfato.
Al igual que sucede con el potasio, las concentraciones séricas de fosfato disminuyen significativamente cuando el paciente es tratado con fluidos e insulina y se corrige la cetoacidosis inicial.
Las complicaciones potenciales de la hipofosfatemia severa incluyen disminución del volumen minuto cardiaco, debilidad de los músculos respiratorios, rabdomiolisis, depresión del sistema nervioso central, convulsiones, coma, insuficiencia renal aguda y anemia hemolítica.
La hipofosfatemia se clasifica en moderada o severa de acuerdo con los niveles séricos de fósforo. Se considera hipofosfatemia moderada a niveles séricos de fósforo de 1,5 a 2,5 mg/dL. En la hipofosfatemia severa, por su parte, los niveles de fósforo se encuentran por debajo de 1,5 mg/dL (0.48 mmol/L).
En la cetoacidosis diabética, se debe realizar reemplazo de fosfato en pacientes en hipofosfatemia severa (concentración sérica 1,5 mg/dL) y en pacientes con hipofosfatemia moderada más hipoxia, anemia o compromiso cardiorrespiratorio concomitante.
Una forma conjunta de tratar los déficits de potasio y fosfato, se logra con la administración por vía IV de fosfato de potasio. El régimen consiste en administrar 0.08 mmol/kg de fosfato de potasio IV para niveles de potasio entre 1 y 2 mg/dL y 0.16 a 0.24 mmol/kg de fosfato de potasio en 4 a 6 horas cuando el nivel de fosforo sérico está por debajo de 1 mg/dL.
La dosis inicial puede incrementarse si el paciente presenta síntomas manifiestos atribuibles a hipofosfatemia, a su vez, la dosis inicial debe disminuirse entre el 25% y el 50% si el paciente está hipercalcémico. Por tal razón el calcio y el fósforo deben ser monitorizados simultáneamente.
Se recomienda administrar la infusión de fosfato a una velocidad de 0,02 a 0,03 mmol/kg por hora (0,6 a 0,9 mg/kg por hora), con control de los niveles séricos cada seis horas.
Transición de la insulina de la forma intravenosa a la forma subcutánea
Un error frecuente en el tratamiento de la cetoacidosis diabética se comete en el momento de la transición de la insulina de la forma intravenosa a la forma subcutánea. La vida media de la insulina intravenosa se mide en minutos y los pacientes pueden presentar una deficiencia rápida de la hormona cuando se suspende la terapéutica intravenosa. Esto puede llevar a la recurrencia de la cetoacidosis. Para evitar este problema, el paciente debe recibir una dosis de insulina de efecto prolongado subcutánea dos o tres horas antes de suspender la infusión intravenosa de insulina regular y seguirse rigurosamente de los esquemas de transición terapéutica previamente aprobadas en la unidad asistencial.
TRATAMIENTO DEL ESTADO HIPEROSMOLAR HIPERGLUCÉMICO NO CETÓSICO (EHHNC)
Los objetivos de la terapéutica del síndrome hiperglucémico hiperosmolar se han agrupado en cuatro etapas:
Administración de fluidos
Cálculo del agua corporal total ACT actual (litros)
El agua corporal total constituye una fracción variable del peso corporal (fracción x peso corporal en Kg), se suele utilizar para este cálculo 0.6 en niños y adultos masculinos jóvenes, mientras se utiliza 0.5 en las mujeres jóvenes y ancianos masculinos, y 0.45 en ancianas.
Si se pretende ser más exactos en el cálculo del agua corporal total se puede utilizar la fórmula de Watson, que mostramos a continuación.
Hombres: ACT (L)
= 2.447 – (0.09156 X edad) + (0.1074 X talla) + (0.3362 X peso)
Mujeres: ACT (L)
= (0.1069 X talla) + (0.2466 X peso) – 2.097
Nota: edad en años, talla en cm y peso en Kg
Cálculo del agua corporal deseada
Donde, el agua corporal total deseada =
Déficit de agua corporal (litros) = ACT deseada – ACT actual
La ecuación para calcular el déficit de agua nos permite estimar el volumen de agua requerido para retornar las concentraciones de sodio a 140 mEq/l, a lo que se debe sumar las pérdidas insensibles y otras pérdidas concurrentes que puedan estar teniendo lugar.
Para la corrección de la hipertonicidad es preciso tener presente en primera instancia el ritmo al que se debe hacer la corrección, y este va a estar determinado por la velocidad de instauración de la hipernatremia; así, cuando esta se desarrolla en un período de horas, la corrección puede ser bastante rápida, pues no se genera edema cerebral ya que los electrólitos que se acumulan en las células cerebrales como adaptación a la hipernatremia, pueden salir de éstas rápidamente, por lo que se recomienda en estos pacientes disminuir las concentraciones séricas de sodio a razón de 1 mEq/L por hora.
Por el contrario siempre que la hipernatremia lleve un tiempo más largo de haberse instalado o se desconozca la data de la misma, se recomienda que las concentraciones plasmáticas de sodio no deban ser disminuidas a un ritmo superior a 0.5 mEq/L por hora y no se debe exceder los 12 mEq/L por día. Esto obedece a las adaptaciones cerebrales que se producen en la hipernatremia de larga data, o sea la acumulación de solutos orgánicos intracelulares, pues en esta situación la rápida disminución de las concentraciones plasmáticas de sodio provocará el movimiento osmótico del agua hacia el interior de las células cerebrales, con el consiguiente edema cerebral, convulsiones y muerte.
Recomendaciones para la corrección de la contracción hipernatrémica del compartimiento extracelular:
La magnitud de la deshidratación es típicamente mayor en el síndrome hiperosmolar hiperglucémico que en la cetoacidosis diabética. En principio, esto parece paradójico debido a que los pacientes con cetoacidosis presentan una carga osmótica doble de cetonas y glucosa. La mayor deshidratación en el síndrome hiperosmolar, a pesar de la falta de severa cetonuria, podría atribuirse al inicio más gradual y a la mayor duración de la descompensación metabólica antes del diagnóstico.
Administración de insulina regular
Administración de potasio
El reemplazo de potasio se basa en sus niveles séricos y puede seguirse el mismo esquema que el recomendado en el tratamiento de la cetoacidosis diabética. La administración de potasio IV debe comenzar tan pronto como se restablezca la diuresis y el potasio sérico disminuya por debajo de 5.5 mEq/L.
Debido al riesgo asociado de producir hipopotasemia severa al penetrar la glucosa junto con el potasio a la célula, está contraindicada la administración de insulina hasta que el nivel de potasio sérico sea superior a 3.3 mEq/L.
En general, no es necesario administrar más de 40 mEq de potasio como sal de fosfato para corregir el déficit de este último.
Resolución
Se considera que el EHHNC está resuelto cuando el paciente no tiene trastornos de conciencia, es capaz de alimentarse y la osmolaridad plasmática efectiva se encuentra por debajo de 315 mmol/L.Bajo estas condiciones está indicada la transición terapéutica de la insulina intravenosa.
DIFERENCIAS Y SIMILITUDES ENTRE LA CETOÁCIDOS DIABÉTICA (CAD) Y EL ESTADO HIPERGLUCÉMICO HIPEROSMOLAR NO CETÓSICO (EHHNC) O COMA HIPEROSMOLAR
Existen diferencias entre el la CAD y EHHNC que nos permiten el diagnóstico diferencial inmediato, sin embargo también existen muchos puntos en común que resulta necesario identificar.
Los pacientes con EHHNC no tienen acumulación de cetoácidos, los niveles de glucemia suelen ser muy elevados, habitualmente superan los 35 mmol/L, la osmolaridad plasmática puede llegar a alcanzar los 380 mmol/L y presentan además trastornos neurológicos, siempre secundarios a la hiperosmolalidad. Además suelen presentar un pH plasmático por encima de 7.3, con bicarbonato que supera los 20 mEq/L y las cetonas en el suero y en la orina son negativas, o solo ligeramente positivas.
A diferencia de lo anterior, los pacientes con cetoacidosis diabética (CAD) se caracterizan por presentar una tríada dada por: hiperglucemia, acidosis metabólica con anión gap aumentado y cetonemia. Los valores de glucemia suelen ser más bajos que en los EHHNC. Si bien es cierto que las diferencias antes señaladas son útiles para hacer la diferenciación, en un grupo importante de pacientes hay superposición de ambos cuadros.
Epidemiología
Se estima que se producen menos ingresos por EHHNC que por CAD y menos del uno por ciento de los ingresos de diabéticos son por esta causa. El EHHNC se presenta más comúnmente en sujetos mayores de 65 años con diabetes tipo 2. La mortalidad del EHH es variable, con tasas que van del 10 al 50%, pero en muchas ocasiones la muerte es causada por la enfermedad de base o las comorbilidades.
Patogenia
La deficiencia de insulina es más severa en la CAD que en EHHNC; la secreción residual de insulina en EHH es suficiente para evitar la cetosis pero no para impedir la hiperglucemia (la concentración de insulina requerida para suprimir la lipolisis es solo la décima parte de la requerida para promover la utilización de glucosa).
Eventos y/o factores precipitantes
En estos pacientes habitualmente se identifica algún evento precipitante del cuadro agudo; entre los eventos más comunes tenemos: infecciones, incumplimiento del tratamiento, accidentes cerebro-vasculares, infarto del miocardio, pancreatitis aguda, tromboembolismo pulmonar, obstrucción intestinal, trombosis mesentérica, golpes de calor, hipotermia, quemaduras, síndrome de Cushing, tirotoxicosis, acromegalia, uso de esteroides, diuréticos tiazídicos, agentes simpaticomiméticos como la dobutamina y la terbutalina, bloqueadores βadrenérgicos, bloqueadores de los canales de calcio, clorpromacina, cimetidina, fenitoína, nutrición parenteral, diálisis peritoneal, entre otros.
Presentación y manifestaciones clínicas
Cuando analizamos la presentación y evolución, hallamos que los pacientes con CAD suelen ser sujetos jóvenes con Diabetes Mellitus tipo 1 (conocida o de debut) y el cuadro evoluciona rápidamente, comúnmente en el curso de un día; mientras que el EHHNC habitualmente se desarrolla en sujetos de más de 65 años con Diabetes tipo 2, y el cuadro se instaura más insidiosamente con poliuria, polidipsia y pérdida de peso de varios días (semanas) de evolución.
Los síntomas neurológicos predominan en los pacientes con EHHNC mientras la hiperventilación (respiración de Kussmaul), el aliento cetónico y el dolor abdominal, se limitan exclusivamente a los pacientes con CAD. Al examen físico, en ambas entidades, además de los síntomas neurológicos se encuentran signos de depleción de volumen, como mucosas secas, disminución de la turgencia cutánea, presión venosa central disminuida, que puede acompañarse de hipotensión, oliguria y shock. La fiebre es rara aun en presencia de infección, debido a la vasoconstricción periférica causada por la hipovolemia.
El deterioro de conciencia guarda relación con la hiperosmolaridad, de modo que habitualmente se presenta cuando la osmolaridad efectiva se encuentra por encima de 320 a 330 mmol/L, lo que explica su mayor frecuencia de presentación en los pacientes con EHHNC respecto a los afectos de CAD. Debe destacarse que la presencia de estupor o coma en pacientes con una osmolaridad plasmática efectiva por debajo de 320 mmol/L, debe hacernos considerar otras causas que puedan modificar el estado de conciencia, y nos obligan a la realización de otras investigaciones como tomografías de cráneos buscando cambios estructurales en el encéfalo (zonas de isquemia, necrosis, hemorragia, etc.).
Algoritmo general de hidratación en la CAD y el EHHNC

Algoritmo general de hidratación en la CAD y el EHHNC
DIAGNÓSTICO DE LAS ALTERACIONES DE LABORATORIO CLÍNICO COMUNES EN EL SHG
Hemograma
Frecuentemente existe leucocitosis con desviación a la izquierda, incluso sin infección. La elevación del hematocrito y de la hemoglobina resulta concordante con la magnitud de la deshidratación.
Urea y creatinina
La mayoría de los pacientes portadores de cetoacidosis diabética presentan elevación de la tasa de urea en sangre en el momento de su ingreso, lo cual refleja un incremento en el catabolismo proteico y una disminución de la función renal secundaria a la deshidratación y el compromiso circulatorio. Algunos autores otorgan valor pronóstico al nivel de urea plasmática y consideran que niveles por encima de 80 mg/dL son un índice desfavorable. Los niveles de creatinina se encuentran falsamente elevados debido a la deshidratación y a la interferencia de los cuerpos cetónicos con la técnica habitual de determinación de creatinina (Jaffe). Los aumentos en las cifras de nitrógeno no proteico se explican por la deshidratación, el estado hipercatabólico, la gluconeogénesis y la presencia de insuficiencia renal aguda.
Uroanálisis
Los hallazgos consisten en glucosuria intensa, escasa excreción de sodio y excreción de potasio normal o elevado. Esta fórmula electrolítica de la orina es la patente de la deshidratación.
Glucemia
La hiperglucemia define a las EHG. En general oscila entre 400 y 800 mg/dL, pero en circunstancias extremas alcanza valores de hasta 1.500 mg/dL.
Aproximadamente el 15% de los pacientes con cetoacidosis diabética tienen valores de glucosa ≤350 mg/dL al ingreso. Esto se observa cuando existen disturbios de la gluconeogénesis (enfermedad hepática, ayuno prolongado, intoxicación alcohólica aguda) o cuando la utilización de la glucosa es muy alta (embarazo). La determinación de la hemoglobina A1C puede brindar una información útil sobre el grado de control metabólico previo al ingreso.
Cuerpos cetónicos
Se puede obtener una determinación semicuantitativa de cuerpos cetónicos en suero o plasma en forma rápida con el empleo de tabletas de nitroprusiato o con tiras reactivas. Una fuerte reacción positiva para cuerpos cetónicos en suero no diluido en un paciente con pH por debajo de 7,25 y glucosuria franca es suficiente para el diagnóstico de cetoacidosis en un diabético.
Las cetonas urinarias son muy útiles para hacer la diferenciación con la CAD, pero debemos tener presente que en ese cuadro se generan dos cetoácidos (βhidroxibutirato y ácido acetoacético) y una cetona neutra (acetona). La prueba con tiras reactivas y la reacción de Imbert utilizan el nitroprusiato, pero este solo reacciona con el acetacetato y la acetona (producidos por la descarboxilación del ácido acetoacético) y no con el β hidroxibutirato que es la cetona que más se produce en la CAD, por lo que puede haber test falsamente negativos. No obstante resulta raro un test negativo en presencia de cetoacidosis severa.
En situaciones en las cuales la cetoacidosis diabética se acompaña de acidosis láctica, una reacción escasamente positiva puede no reflejar la magnitud de la cetonemia, puesto que la alteración del potencial redox favorece la conversión del ácido acetoacético en beta hidroxibutírico.
Hemoglobina glicosilada HbA1C
Resulta útil la medición de la hemoglobina glicosilada, para determinar si se trata de un episodio agudo o es un proceso que tiene cierto tiempo de evolución, en un paciente diabético no diagnosticado o con pobre control de su enfermedad.
Sodio plasmático
Habitualmente el coma diabético cetoacidótico cursa con hiponatremia, la cual puede ser secundaria a:
Potasio
A pesar de la gran depleción de potasio corporal total, la concentración plasmática del catión generalmente es normal o está elevada en el momento del ingreso. La presencia de hiperosmolaridad secundaria a la hiperglucemia en el fluido extracelular conduce a la derivación de agua y de potasio desde el espacio intracelular al espacio extracelular. Esta salida de potasio se incrementa en presencia de acidosis y aumento del catabolismo proteico. Por otra parte, la entrada de potasio a la célula está disminuida como consecuencia de la insulinopenia. El resultado neto de todos estos factores es un cambio marcado en el balance interno del potasio.
La pérdida excesiva de potasio con la orina es responsable del desarrollo de depleción de potasio. La pérdida urinaria de potasio se produce como consecuencia de los efectos de la diuresis osmótica que conduce a un aumento de la oferta de fluidos y de sodio a los sitios secretores de potasio en la nefrona distal. El hiperaldosteronismo secundario consecuente a la depleción de sodio y la presencia de cetoaniones cargados negativamente en el fluido tubular aumentan aún más las pérdidas de potasio.
Es necesario tener muy en cuenta, que inmediatamente después de iniciar la terapéutica adecuada con insulina, el potasio sérico disminuye, en algunas ocasiones en forma brusca, a causa de la pérdida urinaria continuada del catión, la dilución del espacio extracelular, la corrección de la acidosis y la reentrada de potasio al interior de la célula producida por la insulina.
En informes previos se admitía que el déficit total del potasio corporal era de aproximadamente 4 mEq/kg de peso corporal en la cetoacidosis diabética. Estudios más recientes indican que en ciertos casos puede existir un déficit mucho mayor, del orden de los 10 mEq/kg.
Durante el tratamiento de la cetoacidosis diabética se debe realizar la determinación seriada de las concentraciones de potasio sérico. Aunque el electrocardiograma no refleja cuantitativamente su nivel, el monitoreo continuo así como la respuesta de los reflejos tendinosos profundos son elementos clínicos e utilidad para monitorizar los cambios del catión durante el tratamiento.
Fosfato
Al igual que sucede con el potasio, el nivel inicial de fosfato plasmático en la cetoacidosis diabética puede ser alto, normal o bajo, en independencia de la depleción de fosfato total. Las complicaciones potenciales de la hipofosfatemia severa incluyen disminución del volumen minuto cardiaco, debilidad de los músculos respiratorios, rabdomiolisis, depresión del sistema nervioso central, convulsiones, coma, insuficiencia renal aguda y anemia hemolítica. Como resultado de la hipofosfatemia, se produce una marcada deficiencia del 2-3 DPG intraeritrocitario, lo cual puede alterar la liberación de oxígeno hacia los tejidos.
Estado ácido base
En la cetoacidosis diabética, el origen de los iones hidrógeno en exceso son los cetoácidos formados durante el proceso del metabolismo intermedio en ausencia de insulina. El grado de acidemia, determinado por el descenso del pH, depende por una parte de la gravedad del trastorno metabólico y por otra de la eficiencia de los mecanismos de compensación. En la acidosis moderada, el bicarbonato plasmático está por debajo de 15 mEq/l y en la acidosis grave puede ser menor de 9 mEq/l. La hiperventilación compensadora desciende los niveles de la PaCO2 a valores comprendidos entre 10 y 25 mm Hg.
Anión gap
Aunque la cetoacidosis diabética es una típica acidosis metabólica con anión gap elevado en la cual el incremento en los aniones no mensurados es habitualmente equivalente a la reducción en la concentración de bicarbonato, muchos pacientes pueden desviarse de esta generalidad y desarrollar hipercloremia.
Utilizando los datos del balance ácido base y del anión gap, Adrogué y colaboradores comprobaron que el 46% de los pacientes con cetoacidosis diabética tienen una acidosis con anión gap aumentado, 43% tienen acidosis mixta, y 11% tienen acidosis hiperclorémica al ingreso. Luego de ocho horas de terapéutica, el 91% de los pacientes tienen una acidosis mixta o hiperclorémica.
Osmolaridad
Es característico del coma cetoacidótico un aumento de la osmolaridad plasmática. La osmolaridad efectiva normal de los líquidos biológicos es de 285 mOsm/l. La osmolaridad efectiva se calcula con la fórmula:
Osmolaridad plasmática (mmol/L): |
|
|
2(Na) + Glicemia + Urea |
|
VN: 285-295 |
Osmolaridad plasmática (mg/dL): |
|
|
2(Na) + Glicemia/18 + Urea/2,8 |
|
VN: 285-295 |
Características de los desequilibrios hidrominerales presentes en las emergencias hiperglucémicas
La depleción de líquido secundaria a la glucosuria osmótica presente en las emergencias hiperglucémicas, la contracción del espacio extracelular, el balance del sodio y la osmolaridad del plasma y la orina, resultan variables interdependientes que deben ser analizadas de conjunto.
Las alteraciones del equilibrio hidroelectrolítico en las emergencias hiperglucémicas, mantienen una secuencia que resulta obligatorio respetar durante su interpretación y análisis. Estas alteraciones de la homeostasis se manifiesta por:
Es importante destacar, que los pacientes ancianos, con alteraciones de la conciencia, y los pacientes con disturbios en la ingestión y/o absorción de líquidos, no pueden compensar la diuresis osmótica con la ingestión de agua. En estos pacientes esta cadena fisiopatológica se interrumpe, presentándose entonces depleción marcada del agua corporal total con contracción hipernatrémica hipertónica del espacio extracelular.
Puede haber por tanto hiperglucemia con hipernatremia, hiponatremia o normonatremia. Esto es consecuencia de que la concentración sérica de sodio tiende a aumentar por la diuresis osmótica inducida por la glucosuria y tiende a disminuir por el movimiento de agua desde el espacio intracelular al espacio extracelular (hiponatremia dilucional). La concentración de sodio sérico en última instancia refleja el balance entre la dilución del sodio plasmático debida al movimiento osmótico de agua fuera de las células, y el efecto opuesto de concentración del sodio plasmático debida a la diuresis osmótica inducida por la glucosuria. De modo que en pacientes con diabetes mellitus no controlada y acentuada hiperglucemia, la hiponatremia indica deshidratación ligera, una concentración de sodio normal se acompaña de deshidratación moderada y la hipernatremia indica deshidratación hipertónica severa.
Las manifestaciones de la depleción de líquido extracelular dependen de su magnitud y de la osmolalidad plasmática. Dentro de sus síntomas se presenta anorexia, nauseas, vómitos, debilidad, hipotensión ortostática y síncopes. La pérdida de peso es además de un signo importante de la contracción de volumen, un indicador de la magnitud del volumen en déficit. Otros signos incluyen piel poco turgente (pliegue), ojos hundidos, ausencia de sudoración, oliguria y taquicardia.
Existen por tanto tres tipos de contracciones del espacio extracelular en las emergencias hiperglucémicas:
Ocurre generalmente como primer paso, en la secuencia de alteraciones hidroelectrolíticas implicadas en las alteraciones de la hemostasia hídrica presente en las emergencias hiperglucémicas. Su origen se debe a la acumulación de solutos osmóticamente activos restringidos primariamente al líquido extracelular (hiperglucemia). Del incremento de la osmolalidad del líquido extracelular, resulta la transferencia de agua (traslocación) del líquido intracelular al líquido intersticial; la cual diluye el sodio del líquido intersticial y produce hiponatremia. La causa más común de este trastorno es la hiperglucemia, la cual produce una disminución de la concentración plasmática de sodio de 1.6 mEq/l por cada 100 mg/dL de incremento en la concentración de glucosa.
Criterios diagnósticos
El tratamiento consiste en la disminución de la hipertonicidad del líquido extracelular mediante el control de la hiperglucemia.
En esta entidad, las pérdidas de sodio corporal total resultan superiores a las pérdidas de agua corporal (hiponatremia verdadera). Habitualmente el coma diabético cetoacidótico cursa con hiponatremia, la cual puede ser atribuible a una pérdida significativa de sodio con la orina secundaria a la diuresis osmótica. La excreción renal de cetoácidos (β hidroxibutirato, acetoacetato) también lleva a la excreción obligada de cationes. De este modo, la pérdida renal de sodio en la emergencia hiperglucémica, no ocurre solamente de forma secundaria a la diuresis osmótica provocada por la glucosuria, sino también por la cetonuria.
Resulta oportuno puntualizar, que en este tipo particular de disbalance, la hiponatremia no es el resultado de la pérdida de líquido hipertónico desde el espacio extracelular. En estas circunstancias, las pérdidas de líquido son hipotónicas en comparación con la osmolalidad del líquido extracelular LEC, pero estas pérdidas de líquido hipotónico son reemplazadas por líquidos relativamente más hipotónicos. Esto es resultado del incremento de la sed (mayor ingestión de agua) y la liberación no osmótica de hormona antidiurética HAD (mayor retención de agua) que acompaña la depleción de volumen del LEC, estos dos mecanismos en su conjunto son los responsables de la hiponatremia.
En estos pacientes el déficit de sodio corporal total es superior al déficit de agua corporal total. El aumento en la liberación de ADH secundario a la hipovolemia (estímulo no osmótico), resulta determinante en la retención de agua libre y el desarrollo de hiponatremia. El organismo intenta conservar el volumen a expensas de la tonicidad. Debemos tener presente que esta respuesta, si bien produce hiponatremia, no resulta suficiente para conseguir la repleción del LEC, pues solamente la tercera parte del agua retenida se conserva en el LEC (LEC contiene la tercera parte del agua corporal total) y solo la doceava parte permanecerá en el espacio vascular (el espacio vascular contiene la cuarta parte del agua del LEC).
Este tipo particular de disbalance hidroelectrolítico se debe a las pérdidas renales de sodio (diuresis osmótica secundaria a la glucosuria y cetonuria). En estas condiciones la concentración urinaria de sodio es superior a 20 mEq/L y la fracción de excreción de sodio es superior al 1%.
Criterios diagnósticos
Tratamiento
En esta forma de deshidratación del espacio extracelular, las manifestaciones clínicas se deben más a la depleción de volumen que a la hiponatremia. El tratamiento consiste por tanto en la re-expansión del volumen de líquido extracelular con solución salina isotónica y en la corrección de la hiperglucemia.
La administración de solución salina isotónica, corrige la hiponatremia por dos mecanismos: la solución salina tiene una concentración de sodio (154 mEq/l), muy superior a la del plasma hiponatrémico, lo que provoca una elevación de la concentración de sodio de alrededor de 1 mEq/L por cada litro de solución salina administrada, el otro mecanismo y sin lugar a dudas el más importante, consiste en que la administración de volumen elimina el estímulo para la liberación de ADH, lo que permite que se elimine el exceso de agua y se consiga la normonatremia.
Recomendaciones para la corrección de la hiponatremia
Todos los estados hipernatrémicos, son hiperosmolares. La hipernatremia siempre se acompaña de aumento de la osmolalidad plasmática e hipertonicidad, debido a que el sodio no atraviesa libremente las membranas celulares.
En la hipernatremia siempre existe un déficit relativo de agua libre, a pesar de que el organismo se encuentra protegido de la deficiencia de agua libre por dos mecanismos: la sed y el aumento de la concentración urinaria, estimulada por la ADH.
Las pérdidas de agua y la administración de soluciones hipertónicas de sodio (causas potenciales de hipernatremia), habitualmente no producen hipernatremia pues el incremento en la osmolalidad plasmática que en estas situaciones se produce, estimula la liberación de ADH y la sed; las que a su vez conllevan a la disminución de las pérdidas de agua y el aumento en la ingestión de agua, respectivamente. Ambos mecanismos disminuyen las concentraciones de sodio y la osmolalidad plasmática de vuelta a la normalidad. Estos sistemas reguladores son muy eficientes y consiguen mantener la osmolalidad plasmática en el rango de la normalidad, aún ante grandes variaciones en la ingestión de sodio y agua.
La diuresis osmótica secundaria a glucosa, urea u otro soluto, se caracteriza por un elevado volumen urinario, pero con una concentración de sodio y potasio, muy por debajo de sus valores plasmáticos, como consecuencia de la presencia de glucosa y/o cuerpos cetónicos en la orina (solutos orgánicos no reabsorbibles) responsable de la diuresis osmótica.
Atendiendo a las consideraciones anteriores, no es de extrañar que sean los pacientes críticos con vómitos y ausencia de tránsito intestinal, los pacientes con alteraciones del estatus metal (como los pacientes en coma por cetoacidosis diabética y/o coma hiperosmolar) y los pacientes en edades extremas de la vida los más propensos al desarrollo de hipernatremia, pues suelen ser individuos que no pueden compensar las pérdidas urinarias sostenidas de sodio con el mecanismo de la sed.
Causas
Los estados hipernatrémicos asociada a la hiperglucemia se explican por la pérdida neta de agua asociada a la diuresis osmótica y el remplazo insuficiente de las pérdidas obligadas de agua en pacientes con alteraciones de su estatus mental.
Criterios diagnósticos
Manifestaciones clínicas
Los síntomas más comunes de hipernatremia, corresponden a la forma clínica del SHG (en este caso, estado hiperosmolar hiperglucémico no cetósico), junto con los signos de depleción de volumen que pueden ser prominentes y constituyen elementos para el diagnóstico. Las manifestaciones clínicas atribuidas a la hipernatremia per se, incluyen temblores, irritabilidad, ataxia, espasticidad, confusión mental, convulsiones y coma. La enfermedad es más sintomática cuando la elevación del sodio sérico es más aguda.
Los estados hipernatrémicos crónicos se caracterizan por el incremento de la osmolalidad intracelular de las células del sistema nervioso central SNC (acumulación de osmoles ideogénicos). Este incremento en la osmolalidad del SNC previene la deshidratación celular y debe ser tenida muy en cuenta cuando se inicia el tratamiento con insulina, ya que la corrección rápida de la osmolaridad plasmática no ocurre a la misma velocidad que la corrección de la osmolaridad del SNC, produciéndose un disbalance osmolar que provoca el desplazamiento de agua libre hacia el interior del encéfalo y puede llegar a producir edema, convulsiones, coma y muerte. Esta complicación terapéutica es mucho más frecuente en niños.
Tratamiento
El tratamiento agudo de la hipernatremia hipovolémica depende de la magnitud de la depleción de volumen. Si existen evidencias de compromiso hemodinámico, (hipotensión ortostática, oliguria marcada), el agua y la sal en déficit deben de corregirse de forma inicial con solución salina isotónica. Cuando se alcanza la estabilidad hemodinámica el resto del líquido en déficit puede aportarse con dextrosa al 5% o solución salina hipotónica 0.45%.
ESQUEMAS TERAPÉUTICOS DE TRANSICIÓN POSTERIORES A LA INFUSIÓN DE INSULINA
Puntos clave
Cualquiera sea la forma de presentación clínica de la emergencia hiperglucemia, una vez ingresado el paciente en la unidad de cuidados intensivos, existe consenso en suspender de inmediato los hipoglucemiantes orales y/o la insulina basal utilizada previamente por el paciente y sustituir el tratamiento habitual por la infusión de insulina regular endovenosa durante todo el tiempo que el paciente mantenga su estado crítico.
Los elementos de juicio para iniciar la transición de insulina en infusión IV a otros esquemas terapéuticos deben ser particularizados en cada paciente, no obstante se recomienda antes de iniciar la transición terapéutica reunir los siguientes criterios, con vista a evitar su fracaso por recidivas del estado hiperglucémico o por el contrario, episodios de hipoglucemias graves y sintomáticas.
Criterios para iniciar la transición terapéutica con insulina:
Bajo estos criterios, un paciente se considera en condiciones para iniciar su transición terapéutica cuando la enfermedad crítica que motivo su ingreso ha sido superada, sus signos vitales son estables, está hidratado y normovolémico, y sus parámetros de laboratorio muestran glucosa en sangre ≤200 mg/dL, ausencia de cetonuria, bicarbonato sérico ≥18 mmol/L, pH venoso ≥7.30 y anión gap ≤de 12 mEq/L. La transición terapéutica se inicia con la retirada de la infusión de insulina IV dos horas después de iniciado el esquema de transición y administrada la primera dosis de insulina subcutánea.
Si no existe información disponible sobre los regímenes previos de administración de insulina, el esquema estándar para el cálculo de la dosis diaria total de insulina en base al peso del paciente establece:
Este esquema de cálculo de las necesidades de insulina en base al peso, debe aplicarse sólo por excepción en la transición terapéutica de los pacientes ingresados en terapia intensiva, ya que la cuantificación de las unidades de insulina utilizadas en el paciente durante el tratamiento con infusión continua de insulina endovenosa nos ofrece la información real de los requerimientos de insulina diario en el mismo (dosis de insulina diaria total; DDT).
Otro método para el cálculo de la dosis de insulina total del esquema de transición, considera la misma equivalente al 80% de la dosis de insulina diaria total necesaria para mantener el control de la glucemia durante la terapéutica con infusión IV continua. Este cálculo es conservador, y quizás por debajo de los requerimientos diarios de insulina; que deben ser iguales al 100% de la insulina empleada diariamente durante la infusión endovenosa, pero el mismo trata de evitar al máximo los episodios de hipoglucemias severas, que han demostrado tener efectos devastadores sobre la mortalidad por todas causas a los 90 días de egresado el paciente (NICE-SUGAR).
Si se inicia un régimen basal-bolo, la mitad de la dosis calculada para cubrir los requerimientos totales diarios de insulina, se administrará de forma basal con análogos de insulina de acción prolongada como glargine (Lantus) o detemir (Levemir) o insulina de acción intermedia humana (NPH) y la otra mitad dividido en tres bolos preprandiales de insulina de acción ultrarrápida o regular. Por ejemplo, si se utilizó para el control estable de la glucemia 1.5 U/h de insulina regular en infusión continua durante las últimas 24 horas de ingreso en la unidad de cuidados intensivos, entonces la dosis de insulina total diaria del esquema de transición será igual a: 24 X 1.5 X 0.8 = 28,8 unidades de insulina al día.
Para obtener el mejor estimado de insulina basal, la velocidad de infusión debe ser estable por al menos las últimas 18 horas de ingreso del paciente en UCI. Cuando se inicia la transición y se procede a administrar insulina de acción prolongada por vía subcutánea, la infusión de insulina IV debe continuar por dos horas hasta que se estabilicen los niveles séricos de la insulina de acción prolongada administrada por vía subcutánea.
Entendemos por régimen terapéutico intensivo de insulina, un esquema de tratamiento que cubre la mitad de los requerimientos totales diarios de insulina con insulinas de acción intermedia o prolongada y la otra mitad, dividida en tres dosis preprandiales con insulina regular u homólogos de la insulina de acción ultrarrápida. Estos esquemas exigen además la educación del paciente hasta que el mismo sea capaz de realizar el automonitoreo de la glucemia y el ajuste individual de la dosis preprandial de insulina (escala deslizante).
La escala deslizante para la corrección de la hiperglucemia no debe ser la única intervención para su corrección, debido a que es una conducta terapéutica reactiva y no proactiva. De forma adicional, la insulina puede ser utilizada de forma inapropiada cuando la hiperglucemia refleja gluconeogénesis en respuesta a hipoglucemias no corregidas.
Si el paciente a su egreso de terapia, reúne las condiciones para pasar a un régimen de tratamiento intensivo con insulina, se recomienda la utilización de una escala de corrección para la dosis preprandial de insulina.
Ejemplo de escala deslizante para la corrección de la hiperglucemia |
|
Glucosa en sangre (mg/dL) |
Unidades de insulina necesarias (U) |
<140 |
0 |
140–159 |
1 |
160–179 |
2 |
180–199 |
3 |
200–219 |
4 |
220–239 |
5 |
240–259 |
6 |
260–279 |
7 |
280–299 |
8 |
300–319 |
9 |
320–339 |
10 |
>340 |
11 |
Un segundo método empleado para el ajuste de las dosis de insulina preprandial adiciona a la insulina basal, insulina análoga ultrarrápida o insulina humana regular con el fin de corregir o suplementar la glucemia preprandial.
La fórmula más empleada para el ajuste individual de la dosis de insulina preprandial utiliza 1 unidad de insulina por cada 2.7 mmol/L (50 mg/dL) de la glucemia por encima de la meta deseada. La adición de 2 U de insulina ultrarrápida o regular disminuye el nivel de glucemia de 200 mg/dL a 100 mg/dL).
El tercer método de corrección de la glucemia preprandial se establece sobre la base del peso corporal: (peso en Kg) X (glucemia real – la glicemia deseada mg/dL)/1500.
Recomendaciones para el ajuste individual de la dosis de insulina preprandial
Escala deslizante
Protocolos de transición
Aunque el perfil de la insulina describe una curva simétrica y suave, existen considerables variaciones paciente a paciente en la acción pico y duración de su efecto.
En todos los esquemas, las insulinas de acción prolongada (NPH, glargine, or detemir) suplen las necesidades basales, mientras que las insulinas regulares y de acción ultrarrápida (insulina regulara actrapid; insulina aspart, glulisine, o lispro) proporcionan el control prandial. Los análogos de insulina de acción ultracorta deben inyectarse justamente antes (<20 min) o inmediatamente después de los alimentos, mientras que la insulina regular se administra 30–45 minutos antes de los alimentos.
Se ha señalado que el control intensivo de la glucemia con metas y objetivos terapéuticos cercanos a la normalidad, tiene un impacto positivo sobre la supervivencia en pacientes ingresados en unidades de cuidados intensivos postquirúrgicos, en especial unidades dedicadas al cuidado de pacientes sometidos a cirugía cardíaca.
Un ejemplo de estos rigurosos protocolos de transición es el DDD (Division of Cardiology and Intensive Cardiac Care Unit, Ospedale di Desio, Desio) en Italia, el cual especifica, que los pacientes deben recibir el 100% de sus requerimientos diarios de insulina subcutánea desde el primer día de alimentación oral, calculado a partir de la insulina administrada en infusión endovenosa continua, administrada de forma estable, durante las últimas 12 horas de ingreso en terapia; dividido en dos: 50% de insulina basal y 50% de insulina prandial.
Protocolos DDD para la conversión desde la insulina intravenosa continua más infusión de glucosa a insulina subcutánea más alimentación oral |
|
La estimación de los requerimientos combinados de insulina subcutánea y requerimientos nutricionales debe ser extrapolada a partir de la cantidad promedio de la infusión de insulina empleada durante las horas precedentes a la conversión si: |
|
|
|
Protocolo |
Ejemplo |
Paso 1: calcular el promedio de infusión de insulina en las últimas 24 horas para obtener la dosis y multiplicar por 24, lo cual equivale a los requerimientos totales de insulina diaria. |
1.5 unidades/h
= 36 unidades/24 h |
Paso 2: dividir la dosis de insulina para 24 horas para obtener las dosis de insulina análoga de acción prolongada (o NPH) y la dosis total de insulina análoga de acción ultrarrápida (o regular). |
36 unidades/2 = 18 unidades |
Paso 3: administrar el análogo de insulina de acción prolongada como monodosis subcutánea 2 horas antes del primer alimento y descontinuar la infusión IV de insulina y la infusión de destrosa IV. |
Administrar glargine 18 unidades s.c dos horas antes del primer alimento y descontinuar la infusión de insulina y dextrosa al tiempo de alimentarse. |
Paso 4: dividir la dosis diaria total de insulina análoga s.c de acción ultrarrápida en 20% en el desayuno, 40% en el almuerzo y 40% en la comida. |
Administrar lispro 4 unidades s.c. antes del desayuno, lispro 7 unidades s.c. antes de almuerzo y 7 unidades s.c. antes de comida. |
Regular cada 1 -2 días el esquema de tratamiento con análogos de insulin s.c glargine y lispro. Incrementar o disminuir la dosis previa en 10-20% en dependencia de la glucemia pre y postprandial (umbral de glucemia preprandial120 mg/dL, umbral postprandial 160 mg/dL). |
|
Con este protocolo de transición, los episodios de hipoglucemia ocurren en aproximadamente un cuarto de los pacientes durante los 3 primeros días de tratamiento subcutáneo, una frecuencia similar a la observada en otros esquemas de transición de insulina IV a s.c.. |
|
Predictores de éxito durante la transición: Las variables predictivas de fracaso en la transición fueron, la edad avanzada, las dosis elevadas de infusión de insulina IV antes de la transición y amplias fluctuaciones de la glucemia en las 24 horas anteriores a la detención de la infusión de la insulina. |
|
Division of Cardiology and Intensive Cardiac Care Unit, Ospedale di Desio, Desio, Italy |
|
Otros protocolos esquemas de transición, utilizan esquemas menos estrictos y calculan la dosis diaria total DDT en base al 80% del requerimiento diario total de la insulina en infusión, administrada de forma estable, durante las últimas 24 horas de ingreso en terapia. Dada la disponibilidad de insulinas de nuestro país, uno de los esquemas transicionales más utilizado en nuestro hospitales, utiliza un régimen de insulina protamínica (Neutral Hagedorn; NPH) más insulina regular a razón de 70/30. De forma típica las dos terceras partes de la insulina calculada se aplican antes del desayuno y el tercio restante en la noche.
Los pacientes tratados con NPH e insulina regular reciben las 2/3 partes de la dosis diaria total DDT antes de desayuno y la 1/3 parte de la DDT antes de comida. Este régimen prescribe dos tercios de la DDT en la mañana (2/3 de NPH más 1/3 de insulina regular) y la tercera parte restante antes de los alimentos de la noche (la mitad en forma de NPH y la otra mitad regular). Para prevenir la hipoglucemia, no administrar la dosis de insulina regular en pacientes incapaces de ingerir alimentos, se aconseja reducir la NPH al 50% en pacientes con suspensión de la vía oral. La dosis de insulina debe ajustarse diariamente en un 10-20% buscando mantener la glucemia en ayuno por debajo de 120 mg/dL.
Esquema común de 2 inyecciones diarias de insulina de acción prolongada como NPH más insulina de acción rápida regular antes de los alimentos de la mañana y la noche |
||
|
2/3 de la DDT antes del desayuno |
2/3 insulina NPH 1/3 insulina regular |
DDT(1) |
|
|
|
1/3 de la DDT antes de comida |
1/2 insulina NPH. 1/2 Insulina regular. |
DDT: dosis diaria total = 0.8 X 24 X dosis horaria promedio de insulina en infusión (calculada a partir del total de insulina administrado en infusión IV en las últimas 24 horas). |
||
Deslizar la insulina de acción prolongada desde antes de la cena a antes de acostarse evita la hipoglucemia nocturna y proporciona más insulina para el aumento de la glucemia en la madrugada (también conocido como “fenómeno alba”). |
||
Para prevenir la hipoglucemia, no administrar la dosis de insulina regular en pacientes incapaces de ingerir alimentos y reducir la NPH al 50% en pacientes con suspensión de la vía oral. |
||
Este no es un régimen óptimo para los pacientes con diabetes tipo 1, pero en ocasiones se aplica con éxito en la diabetes tipo 2. |
||
Treatment of Patients With Diabetic Ketoacidosis. Diabetes Care 32:1164–1169, 2009. |
||
La transición a los esquemas de tratamiento con los análogos subcutáneos de insulina de acción prolongada (glargine y glulisine) después de la resolución de la emergencia hiperglucémica resultan en igual control de la glucemia pero en una menor incidencia de hipoglucemias que los esquemas que utilizan insulina NPH más insulina regular. Por tanto los esquemas de tratamiento con glargine y glulisine resultan seguros después de la resolución de la hiperglucemia crítica y deben seleccionarse con preferencia, en los países donde esten disponibles; sobre los esquemas de NPH más insulina regular (Insulin Analogs Versus Human Insulin in the Treatment of Patients With Diabetic Ketoacidosis. Diabetes Care 32:1164–1169, 2009)
Ejemplo de dos esquemas intensivos utilizando análogos de insulina de acción rápida (insulin lispro, aspart, o glulisine) más insulina detemir, o insulina glargine en un hombre de 70 kg con diabetes mellitus tipo 1 |
||||
|
Antes del desayuno |
Antes de almuerzo |
Antes de comida |
Antes de acostarse |
Análogo de insulina de acción rápida |
5 U |
4 U |
6 U |
- |
Insulina detemir |
6–7 U |
o |
|
8–9 U |
|
|
|
|
|
Análogo de insulina de acción rápida |
5 U |
4 U |
6 U |
— |
Insulin glargine |
— |
— |
— |
15–16 U |
Asumiendo que el paciente consume aproximadamente 75 g de carbohidratos en el desayuno, 60 g en el almuerzo, y 90 g en la comida. La dosis de insulina análoga de acción ultrarrápida pude incrementarse a razón de 1 o 2 unidades por cada 15-30 g de carbohidratos extras o si la glucemia preprandial resulta >170 mg/dL. La insulina glargine y la insulina detemir deben administrarse en inyecciones separadas. |
||||
Como regla general, la dosis de insulina en todos los esquemas de transición debe ajustarse sobre la base del auto-monitoreo de la glucemia asumiendo los siguientes principios:
SÍNDROME HIPOGLUCÉMICO
La hipoglucemia, es un síndrome de diagnóstico común en las unidades de cuidados intensivos y la misma es una complicación frecuente de las enfermedades críticas en pacientes diabéticos conocidos y pacientes no diabéticos.
Clásicamente, la hipoglucemia ha sido diagnosticada sobre la base de la tríada de Whipple:
Esta descripción inicial, presenta importantes variaciones, en los pacientes graves, donde los trastornos asociados a la falla crítica e insuficiencia de otros órganos no dependientes de la glucemia modifican los síntomas característicos.
Muchas de las comorbilidades presentes en los pacientes críticos y su tratamiento enmascaran las manifestaciones clínicas clásicas de hipoglucemia; tanto los signos de disfunción encefálica como las manifestaciones de la descarga adrenérgica, haciendo muy difícil su diagnóstico. En tal sentido, en ocasiones se hace difícil diferenciar las alteraciones del estatus mental que acompañan a la hipoglucemia severa de las alteraciones mentales en el curso de los accidentes vasculares encefálicos, las meningoencefalitis, los traumas craneoencefálicos, la encefalopatía hipoxia, el usos de analgésicos con acción narcótica, y las drogas utilizadas para la sedación, la relajación muscular y el control de los estados de agitación psicomotora y el delirio.
Los episodios hipoglucémicos pueden tener graves consecuencias de no ser diagnosticados y tratados de forma oportuna, por tal razón su diagnóstico se debe tener en mente ante cualquier paciente con alteraciones del estatus mental, confusión, alteraciones de la vigilia o convulsiones. Estas consideraciones hacen que el monitoreo intensivo de la glucemia sea un estándar de calidad y una práctica obligada en todas las unidades de cuidados intensivos.
Homeostasia sistémica y contrarregulación de la glucosa
La glucosa es el combustible metabólico obligado para el encéfalo en circunstancias fisiológicas. Este órgano necesita un suministro constante de glucosa a través de la sangre arterial. Conforme la glucemia desciende por debajo de los límites fisiológicos, el transporte de glucosa de la sangre al cerebro resulta insuficiente para conservar el metabolismo y la función energética del encéfalo.
En situaciones fisiológicas la concentración de glucosa en el plasma oscila dentro de límites relativamente estrechos que oscilan entre 70 y 110 mg/100 mL (3.9 a 6.1 mmol/L) en ayunas.
La glucemia entre las comidas y en los estados de ayuna se mantiene gracias a la producción endógena de este carbohidrato a través de la glucogenólisis y la gluconeogénesis, ambas en el hígado y riñones. Las reservas hepáticas de glucógeno por lo general sólo bastan para conservar la glucemia durante 8 horas.
La conservación de la glucemia normal, se logra a través de una red de hormonas, señales nerviosas y efectos de sustratos que regulan la producción endógena y la utilización de glucosa en los tejidos extra encefálicos.
La secreción reducida de insulina constituye el primer mecanismo de defensa contra la hipoglucemia. Al disminuir la concentración plasmática de glucosa dentro de los límites fisiológicos del ayuno, la secreción de insulina de las células beta del páncreas se reduce, lo cual incrementa la glucogenólisis y la gluconeogénesis hepática y renal.
Cuando la glucemia desciende por debajo de los límites fisiológicos se liberan hormonas contrarreguladoras que estimula la glucogenólisis y constituyen el segundo mecanismo de defensa contra la hipoglucemia. La principal hormona contrarreguladora es el glucagón, producido por las células alfa del páncreas.
La adrenalina constituye el tercer elemento de defensa contra la hipoglucemia y si esta se prolonga en el tiempo, constituye un estímulo adicional para la liberación de cortisol y la hormona del crecimiento, hormonas contrarreguladoras que favorecen la producción de glucosa y limitan su utilización.
Manifestaciones clínicas
Los síntomas neuroglucopénicos de la hipoglucemia son consecuencia directa de la ausencia de glucosa en el sistema nervioso central (SNC): comprenden cambios conductuales, confusión, fatiga, convulsiones, pérdida del conocimiento, estado de coma y muerte.
Los síntomas neurógenos o autónomos de hipoglucemia son causados por la descarga simpaticoadrenérgica mediada por el SNC, la cual produce liberación excesiva de noradrenalina.
La descarga adrenérgica se manifiesta por palpitaciones, temblor y ansiedad. Abarcan también síntomas colinérgicos (mediados por la acetilcolina liberada desde las neuronas posganglionares simpáticas) como diaforesis, palidez, hambre y parestesias. Estos síntomas resultan inespecíficos para sostener el diagnóstico de hipoglucemia, razón por la cual se hace necesario demostrar niveles de glucosa en el plasma por debajo de los valores fisiológicos y la desaparición de los síntomas con el aporte de glucosa exógena (tríada de Whipple).
Emergencia hipoglucémica
Puntos clave
Causas y fisiopatología del síndrome hipoglucémico
La hipoglucemia a menudo es consecuencia del tratamiento de la diabetes. Por esta razón es necesario investigar este antecedente antes de analizar otras causas.
Factores de riesgo: los factores de riesgo sólo explican un porciento modesto de los episodios de hipoglucemia en los pacientes críticos, entre ellos merecen consideración especial los siguientes.
Hipoglucemia de ayuno
Se conocen muchas causas de hipoglucemia de ayuno. Sin embargo, la causa más frecuente son los fármacos. De las enfermedades graves que originan hipoglucemia la más frecuente es la sepsis.
Fármacos hipoglucemiantes
Las drogas capaces de producir hipoglucemia incluyen: hipoglucemiantes orales, sulfonamidas, fenilbutazona, insulina, anticoagulantes cumarínicos, salicilatos, acido p-aminobenzoico, propoxifeno, haloperidol, etanol (la asociación de propranolol más etanol potencia sus efectos hipoglucemiantes), disopiramida, isoniazida, metanol, metotrexato, pentamidina, clorpromacina, quinina, sulfas, fluoxetina, sertralina, fenfluramina, trimetoprim, 6-mercaptopurina, tioglicolato, inhibidores de la enzima conversora de aldosterona y litio.
La pentamidina tiene efectos adversos en las células beta del páncreas. Al principio provoca la liberación de insulina y aparición de hipoglucemia en 10% de los individuos tratados y más adelante puede originar diabetes.
Se ha publicado que las quinolonas, las sulfas, y en particular la gatifloxacina, provocan hipoglucemia en pacientes tratados con estos fármacos, al igual que algunos antiarrítmicos como la quinidina, la disopiramida y la cibenzolina.
La hipoglucemia también ha sido atribuida a otros fármacos como el propranolol, antagonista adrenérgico beta no selectivo.
Enfermedades graves
En los sujetos hospitalizados enfermedades graves como la insuficiencia renal, hepática o cardíaca, la sepsis y la inanición ocupan el segundo lugar después de los fármacos como causas de hipoglucemia.
La destrucción rápida y extensa del hígado (como en el caso de la hepatitis tóxica) origina hipoglucemia de ayuno puesto que aquí se produce la mayor parte de la glucosa endógena. El mecanismo de la hipoglucemia en los pacientes con insuficiencia cardíaca se desconoce; quizá participan la congestión y la hipoxia hepáticas. Los riñones también producen glucosa, pero la hipoglucemia de los individuos con insuficiencia renal también es ocasionada por la eliminación reducida de insulina y movilización amortiguada de precursores gluconeogénicos en la insuficiencia renal. La sepsis es una causa relativamente común de hipoglucemia y la mayor utilización de glucosa es inducida por la producción de citoquinas en los tejidos con abundantes macrófagos como el hígado, el bazo y los pulmones. La inanición también se acompaña de hipoglucemia, quizá por la pérdida de las reservas corporales de grasa y la ausencia ulterior de precursores gluconeogénicos (como aminoácidos), obligando a una mayor utilización de glucosa.
Deficiencias hormonales
Los pacientes con insuficiencia corticosuprarrenal primaria (enfermedad Addison) o hipopituitarismo padecen hipoglucemia con el ayuno prolongado.
Hipoglucemia reactiva
La hipoglucemia de este tipo (postprandial) aparece exclusivamente después de consumir alimentos. Ha recibido el nombre de hipoglucemia alimentaria y, según expertos, es consecuencia de la hiperinsulinemia precoz causada por los incrementos rápidos en la glucosa plasmática en pacientes generalmente gastrectomizados.
La hipoglucemia reactiva también se observa en individuos con autoanticuerpos contra la insulina.
El síndrome hipoglucémico en cuidados intensivos
En el entorno de los cuidados intensivos merecen especial atención tres situaciones específicas:
A manera de resumen podemos considerar como las causas potenciales frecuentes de hipoglucemia en pacientes diabéticos: los cambios en el régimen terapéutico, cambios en la dieta, enfermedades recientes (fundamentalmente aquellas que se asocian vómitos y pérdida de la alimentación oral efectiva) y las infecciones evidentes u ocultas.
Diagnóstico
El diagnóstico de hipoglucemia se establece cuando la glucemia plasmática se encuentra por debajo de 50 mg/dL; acompañado de alteraciones del estatus mental y/o estimulación del sistema nervioso simpático. El nivel de glucemia con el cual un paciente se hace sintomático resulta altamente variable.
Una concentración de glucosa plasmática menor de 50 mg /dL (2.7 mmol/L) con síntomas que ceden rápidamente cuando aumenta la glucemia corrobora el diagnóstico.
Diagnóstico de hipoglucemia |
||
|
mg/dL |
mmol/L |
Hombres |
<50 |
<2.7 |
Mujeres |
<45 |
<2.5 |
Niños |
<40 |
<2.2 |
Como regla general, la hipoglucemia se considera moderada entre 50 y 30 mg/dL. La hipoglucemia es severa, cuando la glucemia es <30 mg/dL. |
||
Antecedentes e historia clínica del episodio hipoglucémico:
Con frecuencia resulta imposible obtener los antecedentes clínicos debido al estado mental alterado del paciente. Ante esta situación es necesario esclarecer con los familiares la historia de uso de insulina o ingestión de hipoglucemiantes orales.
Deben destacarse los antecedentes clínicos de diabetes mellitus, insuficiencia renal, alcoholismo, insuficiencia hepática, cirugía reciente u otras enfermedades endocrinas, así como el uso de medicamentos relacionados con la producción de hipoglucemia.
Los síntomas y signos que sugieran sepsis (evidente u ocultan) deben ser cuidadosamente detallados.
Examen físico
Las alteraciones del examen físico generalmente no son específicas de hipoglucemia y de forma general solo evidencian alteraciones del sistema nervioso autónomo y central:
Manejo y tratamiento inicial
En esencia el tratamiento de la hipoglucemia consiste en la corrección de la deficiencia de glucosa y el reconocimiento y tratamiento de los factores causales. Durante el tratamiento; los niveles de glucemia deben monitorizarse con frecuencia, debido a que las características clínicas de la hipoglucemia en ocasiones no reflejan la gravedad del episodio.
Todo paciente diabético con alteraciones del estatus mental, debe recibir de inmediato un bolo de glucosa hipertónica intravenosa como tratamiento inicial. Este proceder, no implica riesgos adicionales en pacientes hiperglucémicos y por el contrario resulta salvador en los pacientes hipoglucémicos, donde la demora en el tratamiento puede producir daño encefálico permanente.
Existe una pobre correlación entre la cantidad de los agentes hipoglucemiantes ingeridos y la extensión o profundidad del coma. Todo paciente con antecedentes de sobre dosis o ingestión accidental o inadvertida de hipoglucemiantes orales, debe ingresar de inmediato debido a que la vida media y el comienzo de la acción de los hipoglucemiantes orales resulta extraordinariamente variable. Por tal razón la extensión de la observación intensiva y el monitoreo de la glucemia, está en dependencia del tipo de agente hipoglucemiante implicado en el episodio hipoglucémico.
El tratamiento inicial incluye acceso venoso central, administración de oxígeno suplementario, monitoreo y toma de muestras para la determinación de la glucemia y analítica sanguínea completa.
La piedra angular en el tratamiento de la hipoglucemia es la administración de glucosa. La administración de glucosa como parte de la evaluación inicial de un paciente en coma o con alteraciones del estatus mental, usualmente corrige la hipoglucemia.
El inicio del tratamiento no debe esperar por el resultado de los análisis de laboratorio, debido a que el encéfalo utiliza la glucosa como fuente primaria de energía, y la deficiencia energética secundaria a la hipoglucemia puede producir daño encefálico irreversible.
En pacientes con incapacidad para la ingestión adecuada de glucosa oral, se administrará glucosa endovenosa en bolos o infusión de soluciones hipertónica de glucosa, lo cual incrementa el aporte calórico con un mínimo de sobrecarga hídrica.
Glucagón (bulbos liofilizados de 1 mg)
Esta hormona polipeptídica se produce de forma natural por las células alfa de los islotes de Langerhans en el páncreas y ejerce efectos opuestos a la insulina, mediante la inhibición de la síntesis de glucógeno y la estimulación de la gluconeogénesis, y la glucogenólisis hepática.
Este medicamento resulta de suma utilidad en pacientes con alteraciones del estatus mental y acceso intravenoso difícil.
Dosis en el adulto: 1 a 2 mg por vía IV, IM o SC, puede repetirse cada 2 horas.
Dosis pediátrica:
Peso corporal <20 kg: 0.5 mg, o dosis equivalente a 20-30 mcg/kg
Peso corporal >20 kg: 1 mg por vía IV, IM o SC
Precauciones
Debido a que resulta necesaria la biodisponibilidad de glucógeno hepático para que el glucagon produzca sus efectos, este medicamento no resulta útil en estados hipoglucémicos asociado al uso de biguanidas, o en estados de depleción de los depósitos hepáticos de glucógeno; en los estados de inanición, en la insuficiencia adrenal y en los estados de hipoglucemia crónica.
Criterios de alta hospitalaria
En pacientes que utilizan insulina de acción rápida o agentes hipoglucemiantes que no habían ingerido alimentos o cuyo episodio de hipoglucemia revirtió con rapidez, se recomienda la ingestión de alimentos ricos en carbohidratos previa al alta.
Transferir o dar alta antes de las 24 horas a un paciente que ingresa por hipoglucemia secundaria a la medicación con hipoglucemiantes orales de de acción prolongada es un error frecuente. En estos pacientes, la recurrencia de la hipoglucemia es un fenómeno común.
Previo al alta, los pacientes ingresados con el diagnóstico de hipoglucemia deben recibir educación sobre las causas, signos y síntomas tempranos de hipoglucemia.
Mortalidad: la demora en el tratamiento resulta en una gran variedad de secuelas (algunas irreversibles), que incluyen la muerte.
MANEJO PERIOPERATORIO DE LA GLUCEMIA
Puntos clave
Los pacientes diabéticos¸ durante las operaciones quirúrgicas, electivas o no, presentan elevado riesgo de sufrir tanto eventos de hiperglicemia (secundaria a la medicación insuficiente y al estrés quirúrgico) como hipoglicemia, (secundaria al ayuno perioperatorio) Por tal razón; el manejo de la glucemia en pacientes diabéticos que van a ser sometidos a cirugías electivas debe comenzar el día antes del proceder quirúrgico.
Los hipoglucemiantes orales, especialmente aquellos que estimulan la secreción de insulina, como la sulfonilureas y la meglitinida tienen la capacidad potencial de producir hipoglucemia durante el ayuno previo a la cirugía. De forma adicional, la larga vida media de mucho de estos medicamentos, hacen su regulación difícil en el marco de los cambios rápidos de los parámetros clínicos perioperatorio.
Por tal razón y como regla general, los hipoglucemiantes orales deben administrarse la noche antes y suspenderse en la mañana de la cirugía, aunque existen particularidades en el manejo, que dependen de la vida media y el metabolismo del hipoglucemiante considerado.
El cierre de los canales KATP del corazón, incrementa el riesgo de daño isquémico, por bloqueo de un mecanismo intrínseco de cardioprotección, denominado “preacondicionamiento isquémico”, el cual hace al miocardio más resistente a la injuria. Las sulfonilureas deben suspenderse 24 horas antes de la cirugía electiva debido al riesgo de efectos adversos resultantes del cierre de los canales KATP del miocardio, en adición a riesgo de hipoglicemia.
De forma adicional, las meglitinidas (nateglinida, repaglinida), actúan por un mecanismo similar que involucra el cierre de los canales KATP, y al igual que ocurre con las sulfonilureas, resulta recomendable, suspender estas drogas 24 horas antes de las operaciones electivas.
Existe una alerta marcada ante la posibilidad de acidosis láctica relacionada con la metformina. Los pacientes quirúrgicos, presentan un riego elevado de acidosis láctica debido a la presencia de una gran cantidad de factores predisponentes como insuficiencia renal, hepática y cardíaca, así como hipoxemia e hipovolemia. Por tal razón se recomienda la suspensión de la metformina 24 o más horas antes de la cirugía.
En los pacientes diabéticos que utilizan la insulina de forma habitual, debe realizarse un ajuste de la dosis durante el preoperatorio. La dosis matinal de las insulinas de acción prolongada debe reducirse a la mitad (Lantus, Levemir, NPH) el día de la cirugía. De igual forma, los pacientes que utilizan combinaciones de insulina 70/30 o 75/25 (lenta-regular) deben recibir la mañana de la cirugía, la mitad de la dosis habitual, en forma de NPH.
En comparación con los hipoglucemiantes orales; la insulina regular permite la regulación más rápida y efectiva de la glucemia. Por tal razón, durante todo el periodo de ayuno perioperatorio, el control de la glucemia debe establecerse con insulina regular, dado que los agentes hipoglucemiantes orales, no deben reiniciarse hasta que el paciente sea capaz de alimentarse de forma efectiva.
Como regla general, la aplicación de protocolos para la infusión de insulina regular en el control peri-operatorio de la glucemia resultan más útiles y efectivos que la aplicación de escalas deslizantes simples, y se asocian a menor incidencia de episodios de hipoglucemia.
En tal sentido, se recomienda en los pacientes hiperglucémicos durante el periodo intraoperatorio, el uso de infusión intravenoso de insulina regular (generalmente se utilizan 10 unidades de insulina regular disueltos en 500 ml de solución salina al 5%); con los ajuste de la dosis y velocidad de infusión necesarios para mantener la glucemia, en un rango entre 140 - 180 mg/dL
Simultáneamente, y en orden de prevenir al máximo los eventos hipoglucémicos, se recomienda la infusión de glucosa al 5%, a razón de 125 mL/h y se monitorizan los niveles de glucosa plasmática cada 2 horas durante todo el proceder quirúrgico.
La infusión de glucosa al 5%, debe mantenerse hasta que se inicie la alimentación oral, momento en que se aconseja completar la mitad restante de la dosis de insulina de acción prolongada basal matinal.
Algunos anestesiólogos, prefieren no administrar ningún tipo de insulina por vía subcutánea en el preoperatorio y prefieren monitorizar la glucemia cada 2 horas, luego de administrar 10 unidades de insulina regular, disueltos en 500 ml de solución de glucosa al 5% en infusión IV, a razón de 150 mL/h.El ajuste de la velocidad de infusión, se regula para mantener la glucemia en el rango deseado (140 - 180 mg/dL) durante todo el transoperatorio.
Metas terapéuticas intraoperatorias
Existen fuertes evidencias que demuestran que los niveles de glucemia peri-operatoria se asocian con el pronóstico y evolución de los pacientes. Por ejemplo, en pacientes sometidos a cirugía mayor cardiovascular electiva, los episodios de hiperglucemia severa ocurridos durante el transoperatorio son un fuerte predictor independiente de mortalidad y morbilidad multisistémica.
El rango de glucemia plasmática con menor riesgo de episodios de hipoglicemias asociado a la vez con un mejor pronóstico y evolución más favorable varía entre 140 y 180 mg/dL. Estos resultados sugieren que la hiperglicemia moderada resulta bien tolerada y que el control intensivo de la glucemia durante la cirugía mayor no implica un mejor pronóstico (Curr Pharm Des. 2012; 18(38): 6195–6203).
La hiperglucemia intraoperatoria, definida como 4 o más determinaciones de la glucosa plasmática superiores a 200 mg/dL, se asocia a incremento significativo de la mortalidad, y al aumento proporcional de complicaciones cardiovasculares, respiratorias, renales y neurológicas.
En el otro extremo, ha quedado demostrado que las concentraciones de glucosa plasmática cercanas a la normalidad durante el periodo peri operatorio, también se asocian a un aumento de la morbilidad y la mortalidad. Existe una correlación directa entre los niveles más bajos de glucemia durante el periodo intraoperatorio y el incremento de las complicaciones.
Los resultados demuestran que los pacientes que recibieron tratamiento intensivo con insulina para mantener la glucemia intraoperatoria entre 80 y 110 mg/dL presentan mayor mortalidad y mayor incidencia de accidentes cerebrovasculares durante el postoeperatorio de la cirugía electiva cardíaca, lo cual proporciona fuertes evidencias para afirmar que el control intensivo de la glucemia durante el periodo intraoperatorio de la cirugía cardíaca no produce beneficios sobre la mortalidad o la morbilidad y por el contrario resulta peligroso.
Uso de hipoglucemiantes orales e insulina durante el peri-operatorio de cirugías electivas en pacientes diabéticos. |
|
|
|
Pre-operatorio |
|
Sulfonilureas (glibenclamida, tolbutamida) |
Suspenderse glibenclamida 24 horas antes de la cirugía electiva. Suspender tolbutamida 12 horas antes. |
Biguanidas (metformina) |
Suspender 24 o más horas antes |
Meglitinidas (nateglinida, repaglinida), |
Suspenderse 24 horas antes de la cirugía electiva |
Insulinas de acción prolongada (NPH y análogos). |
Reducir a la mitad en la mañana antes de la cirugía. |
Insulinas 70/30 o 75/25 (pre-mezcladas) |
Administrar en la mañana de la cirugía, la mitad de la dosis habitual, en forma de NPH. |
Los pacientes que van a ser sometidos a procederes quirúrgicos deben recibir en la mañana antes de la cirugía, la inyección de 1/2- 1/3 de la dosis habitual de NPH o el 50% de la dosis de análogos de la insulina (glargine o determir). |
|
Trans-operatorio (ver recomendaciones durante la cirugía) |
|
Infusión de insulina regular IV (en procederes quirúrgicos mayores). Glucometría horaria. |
Ajustar velocidad de infusión hasta alcanzar el rango terapéutico deseado |
Post-operatorio |
|
Insulina |
Completar la mitad restante de la dosis de insulina basal matinal. |
Un objetivo terapéutico razonable, es mantener las concentraciones de glucosa pre y trans-operatoria en un rango entre 140 to 180 mg/dL. |
|
Durante el trans y post operatorio, mantener infusión de glucosa al 5%, a razón de 1 L (50 g de glucosa) a 125 mL/h hasta que se inicie la alimentación oral efectiva. |
|
Recomendaciones para el manejo de los pacientes diabéticos durante la cirugía electiva |
||
|
Cirugía menor (<2 horas, ayuno postoperatorio mínimo) |
Cirugía mayor (>2 horas, invasión de cavidades corporales, ayuno inmediato después de la recuperación) |
DM tipo 2 Pacientes que utilizan insulina basal 1 o 2 veces al día |
No administrar insulina el día de la operación, comenzar con infusión de dextrosa 5% a125 ml/h, glucometría horaria, administrar insulina regular s/c cada 4 horas en esquema deslizante. |
Administrar el 50% de la dosis matinal de insulina basal. Igual régimen que en los procederes menores, si el control es no satisfactorio iniciar insulina regular IV en infusión. |
DM tipo 1 Pacientes que utilizan esquemas de tratamiento intensivo (basal-bolos preprandial) |
No administrar insulina el día de la operación, comenzar con infusión de dextrosa 5% a125 ml/h, glucometría horaria, administrar insulina regular s/c cada 4 horas en esquema deslizante. |
Administrar el 50% de la dosis matinal de insulina basal. Administrar dextrosa 5% a 125 ml/L. Glucometría horaria. Iniciar insulina regular IV en infusión. Transición al régimen habitual tan pronto se inicie la vía oral |
En todos los casos, se suspenden los hipoglucemiantes orales 12 horas antes del acto quirúrgico. |
||
VALORES DE LABORATORIO Y FORMULARIOS DE USO COMÚN EN EL DIAGNÓSTICO Y TRATAMIENTO DE LAS EMERGENCIAS HIPERGLUCÉMICAS
Electrolitos en sudor y secreciones gástricas |
||||||||
Sudor y secreciones |
Concentración electrolítica (mEq/L) |
Reemplazos por litros de pérdida. |
||||||
|
Na+ |
K+ |
H+ |
Cl- |
HCO3- |
SS 0,9% |
Dext 5% |
ClK |
Sudor |
30 -50 |
5 |
- |
45 -55 |
-- |
300 |
700 |
5 |
Secreciones gástricas |
40 -65 |
10 |
90 |
100-140 |
-- |
300 |
700 |
20 |
Fístula pancreática |
135- 165 |
5 |
-- |
55- 75 |
70-90 |
250 |
750 |
5 |
Fístula biliar |
135-155 |
5 |
-- |
80 -110 |
35-90 |
750 |
250 |
5 |
Ileostomía |
120-130 |
10 |
-- |
50 - 60 |
50-70 |
300 |
700 |
10 |
Diarreas |
25 35 |
39-60 |
-- |
20 - 40 |
30-45 |
-- |
1000 |
35 |
Osmolaridad plasmática (mmol/L): 2(Na) + Glicemia + Urea.
VN: 285-295 mmol.
Osmolaridad plasmática (mg/dL): 2(Na) + Glicemia/18 + Urea/2,5
VN: 285-295 mmol
REGLAS PRÁCTICAS
Agua producto de la oxidación de los alimentos |
||
Substrato |
Cantidad |
Formación de agua |
grasas |
100 g |
107 mL |
carbohidratos |
100 g |
55 mL |
proteínas |
100 g |
41 mL |
Balance diario de agua en adultos |
|
Ganancias |
|
Ingestión de agua en forma de líquidos |
1000-1500 mL |
Ingestión de agua en forma de sólidos y semisólidos |
700 mL |
Agua de la oxidación |
300 mL |
GANANCIA TOTAL |
2000-2500 mL |
Pérdidas |
|
Pérdidas con la orina |
1000-15000 mL |
Pérdidas por la piel |
500 mL |
Pérdidas por los pulmones |
400 mL |
Pérdidas por las heces |
100 mL |
PÉRDIDAS TOTALES |
2000-2500 mL. |
Requerimientos adicionales en situaciones clínicas especiales |
|
Elevación de 10C de temperatura |
0.1 - 0.3 L/día |
Sudoración moderada |
0.5 L |
Sudoración profusa, fiebre alta |
1.0 - 1.5 L |
Hiperventilación |
0.5 L |
Hiperventilación en medio muy seco |
1.0 - 1.5 L |
Exposición de grandes heridas y cavidades |
0.5 - 3.0 L |
Las pérdidas insensibles por la piel y los pulmones se calculan a razón de 0.4-0.5 ml/h/Kg de peso corporal, y resultan en aproximadamente 650 a 850 ml/24 horas, en un adulto de 70 Kg.
Cuando hay fiebre debe adicionarse de 50 a 75 ml/día por cada grado de temperatura por encima de lo normal (manual Merck).
CÁLCULO DEL BALANCE HIDROMINERAL
BH (24 horas)= Ingreso – Egreso.
BH (acumulado)= BH diario + BH del día anterior.
|
|
Vía oral |
|
Vía EV (excepto glóbulos y sangre) |
|
Agua endógena: 5 mL / kg. |
|
|
9 mL / kg (en estados hipercatabólicos). |
|
|
Pérdidas obligadas |
Diuresis |
|
Heces Fecales 100 - 200 mL |
|
Diarreas (cuantificación aproximado) |
|
|
Pérdidas insensibles |
15 mL / kg |
|
9 mL / kg ( piel) |
|
6 mL / kg (pulmones) |
|
9 mL / kg (en pacientes ventilados) |
Pérdidas por fiebre
|
|
|
K = 5 temperatura 37 – 37.9°C |
|
K= 10 temperatura 38 – 38.9°C |
|
K= 15 temperatura 39 – 39.9°C |
|
K =20 temperatura >40 |
Pérdidas insensibles en un paciente con polipnea (Caballero) |
|
0.2 ml x kg x hora |
Sí frecuencia respiratoria entre 20 a 28 por minuto. |
0.3 ml x kg x hora |
Sí frecuencia respiratoria entre 28 a 36 por minuto. |
0.4 ml x kg x hora |
Sí frecuencia respiratoria entre 36 a 44 por minuto. |
05 ml x kg x hora |
Sí frecuencia respiratoria mayor de 44 por minuto. |
Superficie corporal (sc)=: 0.012 x peso corporal en libras = m2. |
Desorden |
Proteínas Totales |
Sodio mmol/L |
Hb mmol/L |
Hct mmol/L |
RCC mmol/L |
MCV mmol/L |
MCHC mmol/L |
Rango normal |
|
|
|
|
|
|
|
Hombres |
65-82 g/L |
132-152 |
8.7-11.2 |
40-48 |
4.5-6.1 |
82-93 |
320-360 |
Mujeres |
65-82 g/L |
132-152 |
7.4-9.9 |
36-42 |
4.1-5.3 |
82-93 |
300-340 |
Deshidratación hipotónica |
|
¯ |
|
|
|
|
¯ |
Deshidratación Isotónica* |
|
n |
|
|
|
n |
n |
Deshidratación hipertónica |
|
|
|
|
|
¯ |
|
Sobrehidratación hipotónica |
¯ |
¯ |
¯ |
¯ |
¯ |
|
¯ |
Sobrehidratación isotónica |
|
n |
¯ |
¯ |
¯ |
n |
n |
Sobrehidratación hipertónica |
¯ |
|
¯ |
¯ |
¯ |
¯ |
|
RCC: conteo de células rojas.
MVC: volumen corpuscular medio.
MCHC: concentración de hemoglobina corpuscular media.
Concentración electrolítica de los líquidos corporales |
|||
Electrolito |
Plasma(a)* |
Líq. Intersticial* |
Líq. Intracelular* |
Na+ |
141 |
143 |
10 |
K+ |
4 |
4 |
151 |
Ca+2 |
2.5 |
1.3 |
<0.001(b) |
Mg+2 |
1 |
0.7 |
15 |
Cl- |
103 |
115 |
8 |
HCO3- |
25 |
28 |
10 |
H2PO4 - |
1 |
1 |
65(C) |
SO42- |
0.5 |
0.5 |
10 |
Ácidos orgánicos |
4 |
5 |
2 |
Proteínas |
2 |
<1 |
6 |
pH |
7.4 |
7.4 |
7.2 |
*mmol/L.
COMPARACIÓN DE LAS SOLUCIONES ELECTROLÍTICAS MÁS UTILIZADAS EN CUIDADOS INTENSIVOS
SOLUCIÓN |
OSMOLARIDAD |
Glucosa (g/L) |
Na+ |
Cl- |
DEXTROSA 5% |
252 |
50 |
-- |
-- |
DEXTROSA 10% |
505 |
100 |
-- |
-- |
DEXTROSA 30% |
1512 |
300 |
-- |
-- |
Dextrosa 50% |
2520 |
500 |
-- |
-- |
ClNa 0.45% |
154 |
-- |
77 |
77 |
ClNa 0,9% |
308 |
-- |
154 |
154 |
ClNa 3% |
1026 |
-- |
130 |
109 |
Ringer lactato |
272 |
-- |
130 |
109 |
REQUERIMIENTOS NORMALES DE ELECTROLITOS EN ADULTOS |
|||
Elemento |
Rango normal (suero) |
Valor medio (suero) |
Requerimientos diarios |
Sodio |
132-152 mmol/L. |
142 mmol/L |
1-3 mmol/Kg/día |
Potasio |
3.5-5.5 mmol/L |
4.4 mmol/L |
1-1.5 mmol/Kg/día |
Calcio (total) |
2.15-2.8 mmol/L |
2.45 mmol/L. |
0.05-0.1 mmol/Kg/día |
Calcio (iónico) |
1.35-1.55 mmol/L |
1.45 mmol/L |
Idem |
Magnesio |
0.8-0.1 mmol/L |
0.9 mmol/L |
0.05-0.1 mmol/Kg/día |
Fosfato |
0.9-1.5 mmol/L |
1.2 mmol/L. |
0.2-0.5 mmol/kg/día |
Cloro |
97-110 mmol/L |
103 mmol/L |
1-3 mmol/Kg/día |
REQUERIMIENTOS DIARIOS DE AGUA |
|
1 ml/kcal AEE |
AEE: actual Energy Expenditure |
= 100-150 mL/Kg |
Pacientes con menos 10 kg |
= 1500-1800 mL/m2 |
Pacientes con más de 10 Kg |
VALORES NORMALES EN GASES ARTERIALES
PARÁMETRO |
RANGO NORMAL |
pH |
7.35-7.45 |
PCO2 |
35-45 mm Hg |
Bicarbonato (actual) |
22-26 mmol/L |
Estándar bicarbonato |
20-28 mmol/L |
Exceso de bases |
-3 a 2.5 mmol/L |
Buffer bases |
48 mmol/L |
DIAGNÓSTICO DIFERENCIAL DE LOS DESEQUILIBRIOS ÁCIDO-BASE |
||||
DESORDEN |
pH |
PCO2 mm Hg |
HCO3- mmol/L |
BE mmol/L |
Rango normal |
7.35-7.45 |
35-45 |
20-28 |
-3 a 2.5 |
Acidosis respiratoria compensada |
N |
|
|
|
Acidosis respiratoria no compensada |
¯ |
|
N- |
N- |
Acidosis metabólica compensada |
N |
¯ |
¯¯ |
¯¯ |
Acidosis metabólica no compensada |
¯ |
N-¯ |
¯¯ |
¯¯ |
Alcalosis respiratoria compensada |
N |
¯¯ |
¯ |
¯ |
Alcalosis respiratoria no compensada |
|
¯¯ |
N-¯ |
N-¯ |
Alcalosis metabólica compensada. |
N |
|
|
|
Alcalosis metabólica no compensada |
|
N- |
|
|
El enfoque de los desequilibrios ácido-base se inicia con las siguientes interrogantes:
COMPENSANCIÓN ESPERADA EN LOS DESEQUILIBRIOS ÁCIDO-BASE |
|||
Desorden primario |
Cambio inicial |
Respuesta compensatoria |
Ecuaciones para el cálculo de compensación esperado |
Acidosis metabólica |
Disminución HCO3- |
Disminución pCO2 |
pCO2= 1.5 (HCO3-) + 8±2. PCO2= últimos dos dígitos del pH por 100. pCO2= (HCO3-) + 15. DpCO2= 1 – 1.3 (D[HCO3-]). pCO2 = disminuye en 1– 1.3 mmHg por cada 1 mEq/L de disminución de (HCO3-). |
Alcalosis metabólica |
Incremento HCO3- |
Incremento pCO2 |
pCO2= 0.9 (HCO3-) + 15 pCO2 = incrementa en 0.6–0.7 mmHg por cada 1 mEq/L de incremento de (HCO3-). |
Acidosis respiratoria |
Incremento pCO2 |
Incremento HCO3- |
Aguda: D(H+) = 0,8 (DpCO2). (CO3H-) = 24 + (pCO2 - 40) x 0,1) (HCO3-) incrementa 1 mmol/L por cada 10 mmHg de incremento de pCO2.
Crónica: D(H+) = 0,3 (DpCO2). (CO3H-) = 24 + (pCO2 - 40) x 0,35 (HCO3-) se incrementa de 3 a 5 mmol/L (3.5) por cada 10 mmHg de incremento dela pCO2. |
Alcalosis respiratoria |
Disminución pCO2. |
Disminución HCO3- |
Aguda: (CO3H-) = 24 + (40 - pCO2) x 0,2 D(H+) = 0,8 (DpCO2) (HCO3-) disminuye 2 mmol/L por cada 10 mmHg disminución de pCO2.
Crónica: (CO3H-) = 24 + (40 - pCO2) x 0,4 D(H+) = 0,17 (DpCO2) (HCO3-) desciende 4–5 mmol/L por cada 10 mmHg de disminución de pCO2. |
Osmolalidad plasmática (valor normal de 275-290 mOsmol/Kg). Si está baja, se trata de las denominadas hiponatremias verdaderas (con osmolalidad baja, hipotónicas), pero si por el contrario es normal o alta, debemos siempre comparar la osmolalidad medida con la osmolalidad calculada a partir de las concentraciones séricas de sodio, urea y glucosa, como se muestra a continuación:
Si la glicemia y la urea se miden en mmol/L:
Osmolalidad sérica (mOsmol/Kg) = (2 x Na+) + Urea + glicemia
Si la glicemia y la urea se miden en mg/dL:
Osmolalidad sérica (mOsmol/Kg) = (2 x Na+) + Urea/2.8 + glicemia/18
La diferencia entre la osmolalidad medida y calculada no debe exceder los 10 mOsmol/Kg, o sea la denominada brecha osmolal (osmolalidad gap) normal; cuando la osmolalidad plasmática medida es normal pero el valor calculado es bajo, la más probable causa subyacente de este aumento de la brecha osmolal es una disminución de la proporción de agua plasmática con su contenido normal de sodio, o sea la denominada pseudohiponatremia. Por el contrario cuando la osmolalidad plasmática medida es alta pero la osmolalidad plasmática calculada es normal, este aumento de la brecha osmolal indica la presencia de un soluto no medido que está circulando y contribuyendo a la osmolalidad medida, como se ve en las intoxicaciones por etanol, metanol y etilenglicol.
¿Cómo calcular la osmolalidad plasmática y la osmolalidad gap?
La osmolalidad >10 mOsm/kg H2O sugiere osmolalidad efectiva no dependiente del sodio (manitol, glicina, o sorbitol) o pseudohiponatremia (hiperproteinemia o hiperlipidemia severa. También puede ser vista en presencia e osmolalidad inefectiva (etanol, metanol o etilenglicol), aunque estas últimas sustancias no causan transferencia de agua de un compartimiento a otro o hiponatremia.
Comentarios
Valoración aproximada del balance negativo de agua de un paciente hipernatrémico, suponiendo que la pérdida de agua no ha sido acompañada por una pérdida de sodio concomitante, se obtiene con la siguiente fórmula:
Déficit de agua libre = 0,6 x peso corporal (kg) x [(sodio plasmático/140) - 1]
Como regla general, la mitad de las pérdidas deben reemplazarse en las primeras 12 horas y el resto en un período de 24 a 36 horas.
En los pacientes con hipernatremia secundaria a pérdida de agua pura, se puede estimar el déficit de agua utilizando la siguiente ecuación:
Déficit de agua (l)= agua corporal total x (1-[140/Na+ sérico del paciente])
El agua corporal total constituye una fracción variable del peso corporal (fracción x peso corporal en Kg), se suele utilizar para este cálculo 0.6 en niños y adultos masculinos jóvenes, mientras se utiliza 0.5 en las mujeres jóvenes y ancianos masculinos, y 0.45 en ancianas.
Si se pretende ser más exactos en el cálculo del agua corporal total se puede utilizar la fórmula de Watson, que mostramos a continuación:
Hombres: V (L) = 2.447 – (0.09156 * edad) + (0.1074 * talla) + (0.3362 * peso)
Mujeres: V (L) = (0.1069 * talla) + (0.2466 * peso) – 2.097
Nota: edad en años, talla en cm y peso en Kg
La ecuación para calcular el déficit de agua nos permite estimar el volumen de agua requerido para retornar las concentraciones de sodio a 140 mEq/l, a lo que se debe sumar las pérdidas insensibles y otras pérdidas concurrentes que puedan estar teniendo lugar.
Fórmulas de uso común en el tratamiento de la hiponatremia |
|
|
Estima el efecto de 1 L de cualquier infusión sobre el Na+ sérico. |
|
Estima el efecto de 1 L de cualquier infusión que contenga Na+ y K+, sobre el Na+ sérico. |
Contenido de sodio y distribución en el LEC de las soluciones parenterales de mayor uso |
||
Solución |
Na infundido mmol/L |
Distribución en el LEC % |
Dextrosa 5% |
0 |
40 |
Cloro sodio 0.9% |
154 |
100 |
Cloro sodio 0.45% |
77 |
73 |
Cloro sodio 3% |
513 |
100 * |
Cloro sodio 5% |
855 |
100 * |
Solución de Ringer lactato |
130 |
97 |
En número 1 de la fórmula es una simplificación de la expresión (Na infundido – Na sérico) X 1 Litro, que es el valor calculado para la ecuación en mmol/L. |
||
El estimado del agua corporal total en litros (L), se expresa como una fracción del peso corporal: 0.6 en niños y adultos masculinos jóvenes 0.5 en las mujeres jóvenes y ancianos masculinos 0.45 en ancianas |
||
Normalmente el líquido extracelular e intracelular ocupa el 40% y el 60% del agua corporal total respectivamente. |
||
* En adición a su distribución completa en el líquido extracelar, la transferencia osmótica de agfua desde el comportimiento intracelular. |
||
Adaptado de: Adrogué HJ, Madia s NE. Hyponatremia. N Engl J Med 2000; 342:1581–1589. |
||
Sodio corregido
Se ha considerado por muchos años que por cada 100 mg/dl de elevación de la glicemia por encima de su valor normal, se produce una caída de 1.6 mEq/l de las concentraciones de sodio plasmático; sin embargo un estudio relativamente reciente ha mostrado una relación mayor, sobre todo cuando los valores de glucemia son más elevados (2.4 mEq/l por cada 100 mg/dl (5.5 mmol/L)).
Recomendamos aplicar la segunda relación (2.4 mEq/L por cada 5.5 mmol/L) cuando la glucemia plasmática exceda los 20 mmol/L.
La ecuación sería, para valores de glucemia menores de 20 mMol/l (360 mg/dL):
Δ[Na+]= 1.6 x glucemia en mg/dL/100 ó
Δ[Na+]= 1.6 x glucemia en mmol/L/5.5
Para valores de glucemia mayores de 20 mMol/L (360 mg/dl):
Δ[Na+]= 2.4 x glucemia en mg/dL/100 ó
Δ[Na+]= 2.4 x glucemia en mmol/L/5.5
Pongamos por ejemplo un paciente con una glucemia de 35 mmol/L (630 mg/dl) y una concentración de sodio plasmático de 140 mEq/L:
Δ[Na+]= 2.4 x 35/5.5 = 15.3 mEq/L
[Na+corregida]= 140 -15.3 = 124.7 mEq/L
Para la interpretación debemos considerar que si la concentración de sodio sérico corregido es normal se han perdido líquidos isotónicos, si es mayor que lo normal se han perdido líquidos hipotónicos y si es menor de lo normal no se ha perdido líquidos de forma apreciable.
SISTEMA INTERNACIONAL DE UNIDADES
Comentarios
El Mol (símbolo: mol) es la unidad con que se mide la cantidad de sustancia, una de las siete magnitudes físicas fundamentales del Sistema Internacional de Unidades.
El número de unidades elementales –átomos, moléculas, iones, electrones, radicales u otras partículas o grupos específicos de éstas– existentes en un mol de sustancia es, por definición, una constante que no depende del material ni del tipo de partícula considerado. Esta cantidad es llamada número de Avogadro (NA)y equivale a:
1 mol = 6,02214129 (30)×1023 al que se conoce como número de Avogadro.
En química el osmol (símbolo: Osm u osmole) es una unidad de medida no perteneciente al Sistema Internacional que define el número de moles de un compuesto químico que contribuyen a la presión osmótica de una disolución.
Por ejemplo, una disolución de 1 mol/L de NaCl en agua tiene una osmolaridad de 2osmol/L:
1 osmol = 1 mol de partículas osmóticamente activas
Osmolaridad
La osmolaridad es la medida usada por farmacéuticos, médicos, odontólogos, veterinarios, y biólogos para expresar la concentración total (medida en osmoles/litro en vez de en moles/litro como se hace en química) de sustancias en disoluciones usadas en medicina. El prefijo "osmo-" indica la posible variación de la presión osmótica en las células, que se producirá al introducir la disolución en el organismo.
Osmolaridad sanguínea (mOsm/L) = 2 Na+ + K+ + Glucemia (mg/dL)/18 + BUN (mg/dL)/2,8
Molalidad
En química, la molalidad de una solución (b) se define como la cantidad de sustancia (en moles) de soluto; n soluto dividido por la masa (en kg) del solvente; m solvente (no la masa de la solución)
B= nsoluto
msolvente
Osmolalidad
La osmolalidad es una variación de la molalidad que sólo tiene en cuenta los solutos dentro de la solución que contribuyen a la presión osmótica. Se mide en osmoles de soluto por kilogramo de agua. Está unidad se utiliza con frecuencia en el laboratorio clínico en lugar de la osmolaridad debido a que puede ser medida de forma directa con el osmómetro de descenso crioscópico.
El descenso crioscópico es una propiedad coligativa que depende de la concentración total de partículas en solución, por lo que permite determinar la osmolaridad de las mismas.
Prefijos y abreviaturas internacionales |
||||
Nombre |
Símbolo |
Equivalencia |
||
Litro |
l |
L |
dm3 |
Decímetro cúbico |
Mililitro |
ml |
mL |
cm3 |
Centímetro cúbico |
Microlitro |
μl |
µL |
mm3 |
Milímetro cúbico |
Prefijos y abreviaturas internacionales |
||
Nombre |
Símbolo |
Equivalencia |
Mol |
mol |
Cantidad de partículas elementales que equivale a un número de Avogadro (NA): 1 mol = 6,022 141 29 (30) × 1023 |
Osmol |
Osm u osmole |
Número de moles de un compuesto químico que contribuyen a la presión osmótica de una disolución: 1 osmol = 1 mol de partículas osmóticamente activas |
Osmolaridad |
mOsm/L |
La osmolaridad para expresar la concen-tración total (medida en osmoles/litro en vez de en moles/litro como se hace en química) de sustancias en disoluciones. El prefijo "osmo-" indica la posible variación de la presión osmótica en las células, que se producirá al introducir la disolución en el organismo.
Osmolaridad sanguínea (mOsm/L) = 2 Na+ + K+ + Glucemia (mg/dL)/18 + BUN (mg/dL)/2,8 |
Molalidad |
mol/kg |
En química, la molalidad de una solución (b) se define como la cantidad de sustancia (en moles) de soluto, dividido por la masa (en kg) del solvente (no la masa de la solución) B = |
Osmolalidad |
mOsm/kg |
La osmolalidad es una variación de la molalidad que sólo tiene en cuenta los solutos dentro de la solución que contribuyen a la presión osmótica. Se mide en osmoles de soluto por kilogramo de agua. Puede ser medida de forma directa con el osmómetro de descenso crioscópico. |
REFERENCIAS BIBLIOGRÁFICAS
Recibido: 4 de marzo de 2015 |
Aprobado: 15 de mayo de 2015 |
DSc. Volfredo José Camacho Assef
Hospital Universitario “Dr. Antonio Luaces Iraola”
Calle Máximo Gómez No. 257, entre 4ta y Onelio Hernández. Ciego de Ávila, Cuba. CP.65200
Correo electrónico: volfredo@ali.cav.sld.cu